
| (2011?朝阳区一模)已知:2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-25kJ/mol 某温度下的平衡常数为400.此温度下,在1L的密闭容器中加入CH3OH,反应到某时刻测得各组分的物质的量浓度如下:
|
| c(CH3OCH3)?c(H2O) |
| c2(C3OH) |
| x×x |
| (3.28-2x)2 |


科目:高中化学 来源: 题型:
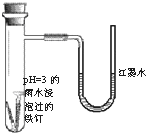 (2011?朝阳区一模)如图是探究铁发生腐蚀的装置图.发现开始时U型管左端红墨水水柱下降,一段时间后U型管左端红墨水水柱又上升.下列说法不正确的是( )
(2011?朝阳区一模)如图是探究铁发生腐蚀的装置图.发现开始时U型管左端红墨水水柱下降,一段时间后U型管左端红墨水水柱又上升.下列说法不正确的是( )查看答案和解析>>
科目:高中化学 来源: 题型:
(2011?朝阳区一模)常温下,有下列四种溶液:
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 水 |
| 自然风干 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com