
| 选项 | 结论 | 原因 |
| A | 将氯气通入H2O2和NaOH的混合溶液中,导管口处发出红光,产生大量的气泡 | 该反应是放热反应,H2O2显示氧化性 |
| B | ZnS能溶解在稀盐酸中,CuS不能溶解在稀盐酸中 | CuS的Ksp比ZnS的Ksp小 |
| C | 在BaCl2和氨水混合溶液中通入CO2,有白色沉淀生成 | NH3在反应中作催化剂 |
| D | 单质硅不溶于浓硫酸和浓硝酸 | 硅被强氧化性酸钝化 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.通气后混合液中产生的ClO-被H2O2还原,发生激烈反应,产生能量较高的氧分子,他立即转变为普通氧分子,将多余的能量以红光放出;
B.溶度积小的不溶;
C.氨气与二氧化碳反应生成碳酸铵;
D.硅与浓硫酸和浓硝酸不反应.
解答 解:A.通气后混合液中产生的ClO-被H2O2还原,发生激烈反应,产生能量较高的氧分子,他立即转变为普通氧分子,将多余的能量以红光放出,体现H2O2的还原性,故A错误;
B.ZnS能溶解在稀盐酸中,CuS不能溶解在稀盐酸中,溶度积小的不溶,则CuS的Ksp比ZnS的Ksp小,故B正确;
C.氨气与二氧化碳反应生成碳酸铵,再与BaCl2溶液反应生成碳酸钡沉淀,氨气为反应物,故C错误;
D.硅与浓硫酸和浓硝酸不反应,硅能与氢氟酸反应,故D错误;
故选B.
点评 本题考查化学实验方案的评价,侧重于考查学生的综合运用化学知识的能力和评价能力,题目难度不大,注意把握相关物质的性质以及实验原理的分析.


 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:实验题
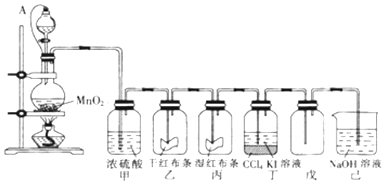
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
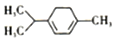
| A. | 该物质属于芳香族化合物,难溶于水 | |
| B. | 该物质可以发生消去、氧化、取代等反应 | |
| C. | 该分子结构中所有碳原子可能共平面 | |
| D. | 该有机物的一氯取代物有7种(不含立体结构) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
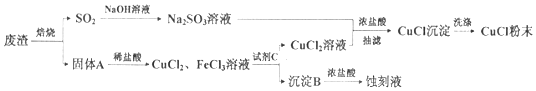
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 海水淡化的常用方法有蒸馏法、离子交换法和电解法 | |
| B. | 钢铁在焊接前可以用NH4C1溶液的酸性清除表面的铁锈 | |
| C. | 甲醛和苯酚通过加聚反应制得酚醛树脂 | |
| D. | 在轮船外壳上焊接锌块或接直流电源正极,均可减缓船体的腐蚀速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 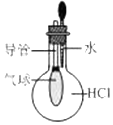 用装置验证 HCl 气体易溶于水 | |
| B. | 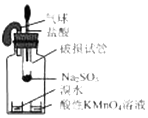 用装置验证 SO2具有漂白性 | |
| C. | 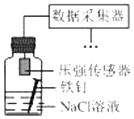 用装置采集到的压强数据判断铁钉发生析氢腐蚀还是吸氧腐蚀 | |
| D. | 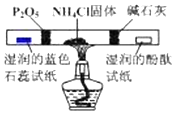 用装置检验 NH4Cl 分解产生的气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 制备气体 | X(除杂试剂) | Y (检验试剂) | 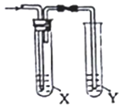 | |
| A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 | |
| B | 电石与NaCl水溶液 | H2O | Br2的CCl4溶液 | |
| C | C2H5OH与浓硫酸 加热至170℃ | 饱和NaHSO3 溶液 | K2Cr2O7酸性溶液 | |
| D | 生石灰与浓氨水 | 浓硫酸 | 红色石蕊试纸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应时间(min) | 1 | 2 | 3 | 4 | 5 |
| 生成氢气体积(ml) | 50 | 150 | 300 | 380 | 410 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com