
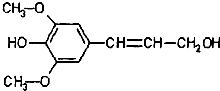
| A、分子式是C11H14O4,属于芳香烃 |
| B、分子中所有碳原子不可能在同一平面 |
| C、不能与Na反应放出H2 |
| D、能发生的反应类型有氧化、取代、加成 |


科目:高中化学 来源: 题型:
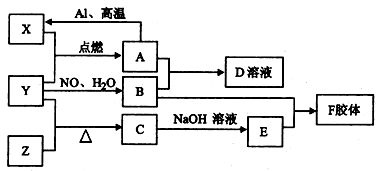
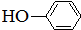 合成
合成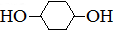 .(部分试剂和反应条件已略去)
.(部分试剂和反应条件已略去)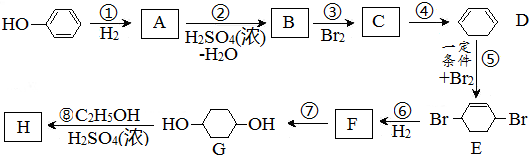
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、白铁(镀锌)的表面一量破损,铁腐蚀加快 |
| B、原电池中电子向负极流动 |
| C、马口铁(镀锡)的表面一旦破损,铁腐蚀加快 |
| D、用铝质铆钉接铁板,铁易被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2 | B、3 | C、5 | D、6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
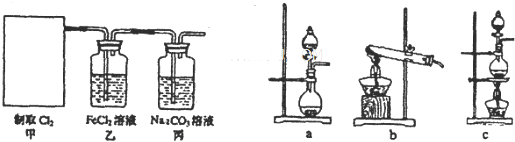
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
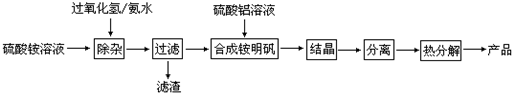
查看答案和解析>>
科目:高中化学 来源: 题型:
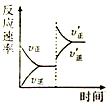 一定条件下,在某密闭容器中进行如下反应:mA(g)+nB(g)?pC(g)+qD(s),若增大压强或升高温度,重新达到平衡,反应速率随时间的变化过程如图所示,则对该反应的叙述正确的是( )
一定条件下,在某密闭容器中进行如下反应:mA(g)+nB(g)?pC(g)+qD(s),若增大压强或升高温度,重新达到平衡,反应速率随时间的变化过程如图所示,则对该反应的叙述正确的是( )| A、正反应是放热反应 |
| B、逆反应是放热反应 |
| C、m+n<p+q |
| D、m+n>p+q |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com