
| A. | 苯 | B. | 乙烷 | C. | 聚乙烯 | D. | 丙烯 |
科目:高中化学 来源: 题型:解答题
 现有14.4gCO和CO2的混合气体,在标准状况下所占的体积约为8.96L.回答下列问题:
现有14.4gCO和CO2的混合气体,在标准状况下所占的体积约为8.96L.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
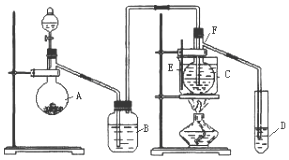
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4个 | B. | 3个 | C. | 2个 | D. | 1个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H++2e-═H2↑ | B. | 2H2O+O2+4e-═4OH- | ||
| C. | Fe-2e-═Fe2+ | D. | 4OH--4e-═O2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 向含有澄清石灰水中通入CO2至产生的沉淀恰好溶解时,若加入NaOH溶液,可观察到沉淀生成 | |
| B. | 向Na2CO3、NaHCO3 的混合溶液中滴加盐酸溶液,均可观察到立即产生气体 | |
| C. | 向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+ | |
| D. | 向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com