
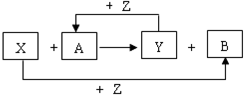
 X、Y、Z为常见的三种单质,Z是绿色植物光合作用的产物之一,A、B为常见化合物.它们在一定条件下可发生如图所示的反应(均是在非溶液中进行的反应):
X、Y、Z为常见的三种单质,Z是绿色植物光合作用的产物之一,A、B为常见化合物.它们在一定条件下可发生如图所示的反应(均是在非溶液中进行的反应):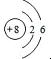 ;
; 或
或 ;
;分析 X、Y、Z为常见的三种单质,Z是绿色植物光合作用的产物之一,故Z为O2,由Y+Z→A可知A为氧化物,X+Z→B可知B为氧化物,由转化关系X+A→Y+B为:单质(X)+氧化物(A)→单质(Y)+氧化物(B),符合置换反应,单质X具有还原性,结合常见单质解答,
(1)Z是绿色植物光合作用的产物之一为氧气,氧原子的核内质子数为8,核外有2个电子层,第一层上有2个电子,第二层上有6个电子
(2)当X为金属,Y为非金属时,当X为金属,Y为非金属时,X为Mg或Fe,A为CO2或H2O,Y为C或H2,B为MgO或Fe3O4,符合转化关系;
(3)当X为非金属,Y为金属时,X为H2或C,Y为CuO等,符合转化关系;
(4)当X与Y均为金属时,考虑铝热反应,A为Al,B为Fe3O4(或Fe2O3),符合转化关系;
(5)当X与Y均为非金属时,若X与Y同主族,X为C单质,B为SiO2,符合转化关系;
若X与Y不在同一主族,X为C单质,B为H2O,符合转化关系.
解答 解:X、Y、Z为常见的三种单质,Z是绿色植物光合作用的产物之一,故Z为O2,由Y+Z→A可知A为氧化物,X+Z→B可知B为氧化物,由转化关系X+A→Y+B为:单质(X)+氧化物(A)→单质(Y)+氧化物(B),符合置换反应,单质X具有还原性,
(1)Z是绿色植物光合作用的产物之一为氧气,氧原子的核内质子数为8,核外有2个电子层,第一层上有2个电子,第二层上有6个电子,其原子结构示意图为:
故答案为: ;
;
(2)当X为金属,Y为非金属时,X为Mg或Fe,A为CO2或H2O,Y为C或H2,B为MgO或Fe3O4,符合转化关系,发生反应为2Mg+CO2,$\frac{\underline{\;点燃\;}}{\;}$C+2MgO,3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,A的电子式为:二氧化碳为直线型结构,分子中存在两个碳氧双键,二氧化碳的电子式为: ,水中存在两个氧氢键,氧原子最外层达到8电子稳定结构,水的电子式为:
,水中存在两个氧氢键,氧原子最外层达到8电子稳定结构,水的电子式为: ;
;
故答案为: 或
或 ;
;
(3)当X为非金属,Y为金属时,X为H2或C,Y为CuO等,符合转化关系,
发生反应为H2+CuO$\frac{\underline{\;高温\;}}{\;}$Cu+H2O(或C+2CuO$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑等);
故答案为:H2或C;
(4)当X与Y均为金属时,考虑铝热反应,A为Al,B为Fe3O4(或Fe2O3),符合转化关系,
反应方程式为:8Al+3Fe3O4 $\frac{\underline{\;高温\;}}{\;}$9Fe+4Al2O3(或2Al+Fe2O3 2Fe+Al2O3);
故答案为:8Al+3Fe3O4 $\frac{\underline{\;高温\;}}{\;}$9Fe+4Al2O3(或2Al+Fe2O3 $\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3);
(5)当X与Y均为非金属时,若X与Y同主族,X为C单质,B为SiO2,符合转化关系,
反应方程式为:2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑;若X与Y不在同一主族,X为C单质,B为H2O,符合转化关系,反应方程式为:C+H2O$\frac{\underline{\;高温\;}}{\;}$H2+CO;
故答案为:2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑;C+H2O$\frac{\underline{\;高温\;}}{\;}$H2+CO.
点评 本题以无机框图题的形式考查中学置换反应、元素单质及其化合物之间的相互转化关系,根据要求选择适合的反应,难度较大,以考查学生的对基础知识的熟练掌握程度为主.


 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:解答题
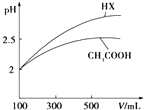 已知25℃时部分弱电解质的电离平衡常数数据如表所示:
已知25℃时部分弱电解质的电离平衡常数数据如表所示:| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | Ka=1.8×10-5 | Kal=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
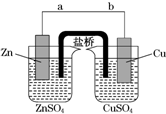 某学生利用如图实验装置探究盐桥式原电池的工作原理(Cu元素的相对原子质量为64).按照实验步骤依次回答下列问题:
某学生利用如图实验装置探究盐桥式原电池的工作原理(Cu元素的相对原子质量为64).按照实验步骤依次回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分馏石油时,温度计的水银球必须插入液面下 | |
| B. | 用浓氨水洗涤做过银镜反应的试管 | |
| C. | 配制银氨溶液时,将稀氨水慢慢滴加到稀硝酸银溶液中,产生白色沉淀后继续滴加直至沉淀刚好溶解为止 | |
| D. | 蔗糖水解后,直接滴加新制氢氧化铜悬浊液并加热检验水解产物中的葡萄糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 位于同一主族的元素的价电子数相同,则各元素的常见化合价也一定相同 | |
| B. | 碱金属族元素同卤族元素一样,其单质的熔沸点随元素原子序数的增大而逐渐升高 | |
| C. | 若x是ⅡB族中元素的原子序数,那么原子序数为x+1的元素是ⅢA族 | |
| D. | 在周期表中金属和非金属元素的分界线附近的元素是过渡元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com