
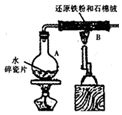
 某校化学小组学生利用如图所示装置进行“铁与水反应”的实验,并探究固体产物成分(图中夹持及尾气处理装置均已略去).
某校化学小组学生利用如图所示装置进行“铁与水反应”的实验,并探究固体产物成分(图中夹持及尾气处理装置均已略去).
分析 I.(1)装置B中,水蒸气和铁粉高温下发生氧化还原反应,生成Fe3O4和氢气;
II.得到固体质量为28.8g,加入过量稀盐酸充分反应,得到浅黄色溶液,应为FeCl3,加入试剂a变为淡红色,则加入的试剂为KSCN,加入新制备氯水,溶液颜色加深,说明Fe3+浓度增大,Fe2+被氯水氧化生成Fe3+,然后加入氢氧化钠溶液,可得到氢氧化铁固体,经过滤、加强热,可分解生成红棕色氧化铁固体;
可取少量褪色后的溶液,再滴加过量KSCN溶液,如果出现红色,说明被KSCN氧化,反之+3价铁被氧化;
解答 解:I.装置B中,水蒸气和铁粉高温下发生氧化还原反应,生成Fe3O4和氢气,方程式为3Fe+4H2O(g) $\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2,
故答案为:3Fe+4H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2;
Ⅱ.(1)得到固体质量为28.8g,加入过量稀盐酸充分反应,得到浅黄色溶液,应为FeCl3,加入试剂a变为淡红色,则加入的试剂为KSCN,加入新制备氯水,溶液颜色加深,说明Fe3+浓度增大,Fe2+被氯水氧化生成Fe3+,然后加入氢氧化钠溶液,可得到氢氧化铁固体,经过滤、加强热,可分解生成红棕色氧化铁固体,
故答案为:KSCN;NaOH;
(2)加入新制氯水后溶液红色加深的原因是亚铁离子被氧化,方程式为2Fe2++Cl2=2Fe3++2Cl-,
故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(3)①某同学在实验中加入了过量氯水,放置一段时间后,发现深红色褪去,可能原因是+3价铁被氧化或SCN-被过量的氯水氧化,
故答案为:SCN-被过量的氯水氧化;
②为了对所提出的假设2进行验证,实验方案是可取少量褪色后的溶液,再滴加过量KSCN溶液,如果出现红色,说明被KSCN氧化,反之+3价铁被氧化,
故答案为:取少量褪色后的溶液,滴加过量KSCN 溶液,如果出现红色,则说明假设2 正确,若不变红,则假设2 不正确.
点评 本题考查物质的含量测定以及性质实验方案的设计,为高考常见题型,题目以铁以及其化合物的相互转化为载体,侧重于实验方案设计与评价,题目难度中等,注意把握实验原理和实验目的.


科目:高中化学 来源: 题型:选择题
| A. | 124 g P4含有P-P键的个数为4NA | |
| B. | 60gSiO2中含Si-O键的个数为2NA | |
| C. | 12 g石墨中含有C-C键的个数为1.5NA | |
| D. | 36 g戊烷中共价键的个数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1}{14}$ mol•L-1 | B. | $\frac{4}{5}$ mol•L-1 | C. | $\frac{1}{28}$ mol•L-1 | D. | $\frac{1}{42}$ mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
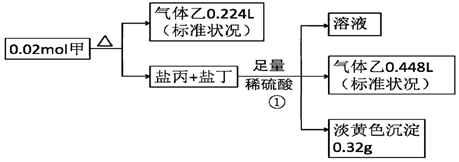
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
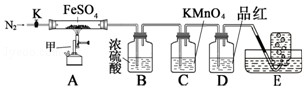
| 实验 | 滴定管 开始读数 | 滴定 终点读数 |
| 1 | 0 | 19.98 |
| 2 | 0.10 | 20.12 |
| 3 | 0 | 20.16 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 元素 | 相 关 信 息 |
| A | 原子核外有7种运动状态不同的电子 |
| B | 外围电子排布式为nsnnpn+2 |
| C | 常见的金属,在周期表中周期序数与族序数相等 |
| D | 气态氢化物及最高价氧化物对应的水化物均为强酸 |
| E | 一种核素的质量数为56,中子数为30 |
| F | 单质紫红色,电缆材料,常见氧化物为黑色 |
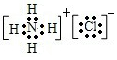
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
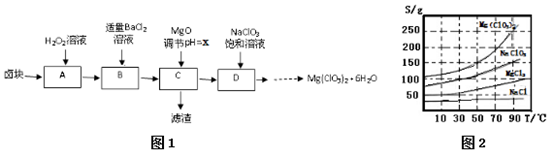
| 化学式 | Fe(OH)2 | Fe(OH)3 | Mg(OH)2 |
| Ksp | 8.0×10-16 | 8.0×10-38 | 1.8x10-11 |
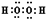
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
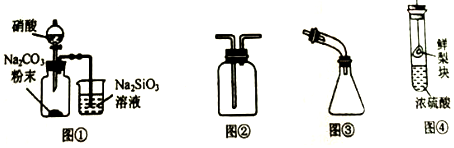
| A. | 图①:证明非金属性由强到弱的顺序是N>C>Si | |
| B. | 图②:收集NO2或NH3 | |
| C. | 图③:海水蒸馏时接收蒸馏水 | |
| D. | 图④:探究浓硫酸的脱水性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com