
分析 (1)燃烧热是指1mol纯净物完全燃烧生成稳定的氧化物放出的热量;中和反应反应热:稀的强酸与强碱溶液反应生成1mol水放出热量,以此解答该题;
(2)根据2.00g C2H2气体完全燃烧生成液态水和CO2,放出99.6kJ的热量,计算1molC2H2燃烧放出的热量,结合化学方程式书写热化学方程式.注意物质的聚集状态和反应热的单位等问题;
(3)依据盖斯定律D-B的CO(g)+$\frac{1}{2}$O2(g)=CO2(g)据此解答;
(4)依据中和热测定步骤及量热计构造解答.
解答 解:(1)A.2H2(g)+O2(g)═2H2O(l)△H1中氢气的物质的量不是1mol,所以△H1不能表示燃烧热,故A错误;
B.C(s)+$\frac{1}{2}$O2(g)═CO(g)△H2=-Q1kJ•mol-1,生成产物不是最稳定氧化物,所以△H2不能表示燃烧热,故B错误;
C.CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H3,生成水为气体,不是最稳定氧化物,所以△H3不能表示燃烧热,故C错误;
D.C(s)+O2(g)═CO2(g)△H4=-Q2kJ•mol-1,碳的物质的量为1mol生成物二氧化碳为稳定氧化物,所以△H5能表示燃烧热,故D正确;
E.NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H5,符合中和热定义,△H5能表示中和反应反应热,故E正确;
故答案为:△H4;△H5;
(2)C2H2气体完全燃烧反应的化学方程式为:2C2H2+5O2$\stackrel{点燃}{→}$4CO2+2H2O,2.00g C2H2气体n(C2H2)=$\frac{2g}{26g/mol}$=$\frac{1}{13}$mol,放出99.6kJ的热量,则1molC2H2燃烧放出的热量为:99.6kJ×13=1294.8KJ,则热化学方程式为:2C2H2(g)+5O2=4CO2(g)+2H2O(l)△H2=-2589.6kJ•mol-1;
故答案为:2C2H2(g)+5O2=4CO2(g)+2H2O(l)△H2=-2589.6kJ•mol-1;
(3)依据盖斯定律D-B的CO(g)+$\frac{1}{2}$O2(g)=CO2(g),所有反应的焓变为△H=(Q1-Q2)kJ•mol-1;
故答案为:(Q1-Q2)kJ•mol-1;
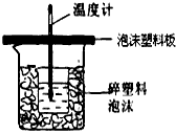
(4)反应E的△H6可以用如图所示的装置进行测量.实验中直接测定的数据是温度;
量热计应带环形玻璃搅拌棒;大烧杯上如不盖硬纸板,导致热量损失,所有求得的中和反应的反应热的数值偏小;
故答案为:温度;环形玻璃搅拌棒;偏小.
点评 本题考查了反应热,明确燃烧热、中和热的概念是解题关键,注意盖斯定律的计算方法,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | BaCl2 Na2CO3 AgNO3 盐酸 | B. | BaCl2 Na2CO3 盐酸 AgNO3 | ||
| C. | Na2CO3 盐酸 AgNO3 BaCl2 | D. | AgNO3 盐酸 BaCl2 Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将两种带相反电荷的胶体混合,能发生聚沉 | |
| B. | 有化学键断裂的变化一定是化学变化 | |
| C. | IA族元素形成的单质的熔点随原子序数的递增而降低 | |
| D. | 碱性氧化物一定是金属氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过滤时,为了加快过滤速率,可用玻璃棒在过滤器内搅拌 | |
| B. | 用蒸发皿蒸发溶液时,边加热边用玻璃棒搅拌,直到液体全部蒸干 | |
| C. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| D. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “另一种反应物”一定只具有氧化性 | B. | “另一种反应物”一定具有还原性 | ||
| C. | 点燃时:2CuH+3Cl2═2CuCl2+2HCl | D. | CuH 既可做氧化剂也可做还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”).
;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”). .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com