
| A. | 用如图装置除去乙烷中混有的乙烯 | |
| B. | 配制一定物质的量浓度的溶液,定容时仰视刻度,溶液浓度偏大 | |
| C. | 制备乙酸乙酯时,将乙醇和乙酸依次加入浓硫酸中 | |
| D. | 玻璃仪器洗涤干净的标准是:附着在仪器内壁上的水既不聚集成滴,也不成股流下 |
分析 A.高锰酸钾能将乙烯氧化为二氧化碳;
B.仰视刻度线,会导致加入的蒸馏水体积偏大,配制的溶液浓度偏低;
C.制取混合酸时,需要类比浓硫酸的稀释进行操作,应该将浓硫酸加入到乙醇中;
D.当玻璃仪器附着在仪器内壁上的水既不聚集成滴,也不成股流下时,可说明洗涤干净.
解答 解:A.高锰酸钾能将乙烯氧化为二氧化碳混于乙烷中成为新的杂质,故A错误;
B.配制一定物质的量浓度的溶液,定容时仰视刻度,会导致加入的蒸馏水体积偏大,配制的溶液浓度偏低,故B错误;
C.浓硫酸溶于水放出大量的热,且密度比水大,为防止酸液飞溅,应先在烧瓶中加入一定量的乙醇,然后慢慢将浓硫酸加入烧瓶,边加边振荡,不能先加入浓硫酸再加入乙醇,故C错误;
D.当玻璃仪器附着在仪器内壁上的水既不聚集成滴,也不成股流下时,可说明洗涤干净,故D正确.
故选D.
点评 本题考查较为综合,涉及物质的制备、分离、提纯以及溶液配制等,为高频考点,侧重于学生的分析能力和实验能力的考查,注意相关基础知识的积累,难度不大.


科目:高中化学 来源: 题型:多选题
| A. | 价电子排布为4s24p2的元素位于第四周期第ⅤA族,是P区元素 | |
| B. | 1,2-二甲苯核磁共振氢谱中有三组峰,且氢原子数之比为3:1:1 | |
| C. | 钠原子由1s22s22p63s1→1s22s22p63p1时,原子释放能量,由基态转化成激发态 | |
| D. | 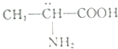 分子属于手性分子 分子属于手性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲、乙、丙是三种常见单质,A、B、C是常见化合物,B在常温下为液态.在一定条件下上述物质之间的关系如图.
甲、乙、丙是三种常见单质,A、B、C是常见化合物,B在常温下为液态.在一定条件下上述物质之间的关系如图.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4HSO4溶液中离子浓度大小关系:c(H+)>c(SO42-)>c(NH4+)>c(OH-) | |
| B. | 等体积pH=a的醋酸与pH=b的NaOH溶液恰好中和,则a+b=14 | |
| C. | Na2C2O4溶液中:c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4) | |
| D. | NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氧化-还原反应是中学化学中一类重要的反应类型,在日常生活中很常见,请回答:(1)在反应3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O中.当产生标况下4.48L气体时,消耗单质铜19.2g,此时转移了0.6mol电子.
氧化-还原反应是中学化学中一类重要的反应类型,在日常生活中很常见,请回答:(1)在反应3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O中.当产生标况下4.48L气体时,消耗单质铜19.2g,此时转移了0.6mol电子.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 仪器标号 | 仪器中所加物质 | 作用 |
| A | 亚硫酸钠、浓硫酸 | 产生SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用CH3COOH溶解CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 二氧化硫通入次氯酸钠溶液:SO2+ClO-+OH-=SO42-+Cl-+H2O | |
| C. | 硫酸工业尾气中的SO2用过量的氨水吸收:2NH3•H2O+SO2=2NH4++SO32-+H2O | |
| D. | Cu溶于浓HNO3:Cu+4H++2NO3-=Cu2++2NO↑+4H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com