
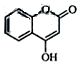
 是一种医药中间体,常用来制备抗凝血药.其分子式为:C9H6O3.其中含氧官能团的名称为羟基、酯基.
是一种医药中间体,常用来制备抗凝血药.其分子式为:C9H6O3.其中含氧官能团的名称为羟基、酯基.  天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
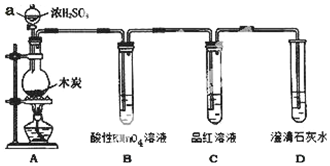 为了探究木炭与浓H2SO4反应的产物中是否存在CO2,某同学选用如图所示装置进行实验:
为了探究木炭与浓H2SO4反应的产物中是否存在CO2,某同学选用如图所示装置进行实验: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaH2的电子式为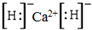 | |
| B. | Cl-的结构示意图: | |
| C. | 质子数为92、中子数为146的U原子:${\;}_{92}^{146}$U | |
| D. | 2,4,6-三硝基苯甲酸结构简式: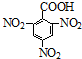 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同温同压下,相同质量的气体都占有相同的体积 | |
| B. | 同温同压下,相同体积的气体都含有相同数目的分子 | |
| C. | 在标况下,1摩尔任何物质的体积均约为22.4升 | |
| D. | 1摩尔某气体的体积约为22.4升,该气体所处的状况一定是标况下 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠的还原性很强,只能以化合态存在于自然界 | |
| B. | 钠质地柔软,可用小刀切割,保存在煤油中 | |
| C. | 钠失火后可用大量水或泡沫灭火器扑灭 | |
| D. | 钠的焰色反应为黄色,可用在雾天做指示灯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫元素的质量比为5:4 | B. | 分子数之比为1:1 | ||
| C. | 原子总数之比为2:3 | D. | 质量之比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验 | pH | 现象 |
| a | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
| b | 6 | 产生白色沉淀,一段时间后,沉淀未溶解 |
| c | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com