
| A. | K(HF)=7.2×10-4 | B. | K(HNO2)=4.9×10-10 | ||
| C. | 反应NaCN+HF═HCN+NaF可以发生 | D. | K(HCN)<K(HNO2)<K(HF) |
分析 相同温度下,酸的电离常数越大,该酸的酸性越强,结合强酸制取弱酸分析解答.
解答 解:根据强酸制取弱酸知,这三种酸的酸性强弱顺序是HCN<HNO2<HF,相同条件下,酸的酸性越强其电离平衡常数越大,所以这三种酸的电离平衡常数大小顺序是K(HCN)<K(HNO2)<K(HF),
A.K(HF)=7.2×10-4 ,故A正确;
B.K(HNO2)=4.6×10-4,故B错误;
C.根据强酸制取弱酸知,这三种酸的酸性强弱顺序是HCN<HNO2<HF,所以反应NaCN+HF═HCN+NaF可以发生,故C正确;
D.由分析可知,K(HCN)<K(HNO2)<K(HF),故D正确;
故选B.
点评 本题考查了弱电解质的电离,明确弱酸酸性强弱与电离平衡常数的关系是解本题关键,难度不大,侧重于基础知识的考查,注意根据强酸制弱酸原理分析.


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:选择题
| A. | 氯元素的化合价升高 | B. | Fe(NO3)3是氧化剂 | ||
| C. | 铁元素被氧化 | D. | NaOH发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑤ | B. | ①③⑥ | C. | ②③⑤ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
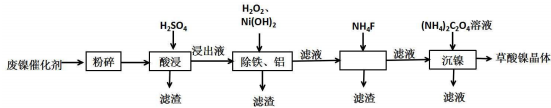
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Al3+ | 3.0 | 5.0 |
| Ni3+ | 6.7 | 9.5 |
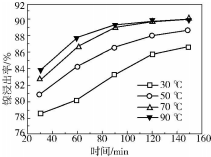
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
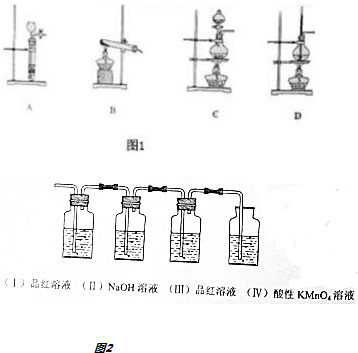
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,则一定有NH4+ | |
| B. | 加入氯化钡有白色沉淀产生,再加盐酸,沉淀不消失,该溶液一定有SO42- | |
| C. | 加入稀盐酸,产生能使澄清石灰水变浑浊的无色气体,则原溶液中一定有CO32- | |
| D. | 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,则一定有Ca2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 牺牲阳极的阴极保护法利用的是原电池原理 | |
| B. | Fe2+能与[Fe(CN)6]3-反应生成带有特征蓝色的沉淀 | |
| C. | 电解质溶液的导电过程一定是电解质溶液的电解过程 | |
| D. | 如果在1.0L Na2CO3溶液中溶解0.010mol的BaSO4,则Na2CO3溶液的最初浓度不得低于0.24 mol/L[已知Ksp(BaSO4)=1.1×10-10; Ksp(BaCO3)=2.6×10-9] |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com