
【题目】请回答下列问题:
(1)已知:N2、O2分子中化学键的键能分别是946kJ·mol-1、497 kJ·mol-1,N2(g)+O2(g)=2NO(g) ΔH=+180.0kJ·mol-1。则相同条件下破坏1molNO中化学键需要吸收的能量为_______kJ。
(2)25℃时,pH=5的CH3COOH溶液中,由水电离出的氢离子浓度c(H+)=____ kJ·mol-1;若加入少量NaOH固体,则溶液中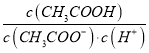 _____(填“增大”、“减小”或“不变”)。
_____(填“增大”、“减小”或“不变”)。
(3)25℃下,向某Na2CO3溶液中加入稀盐酸,其含碳元素的微粒物质的量分数(φ)随溶液pH变化的部分情况如图所示。
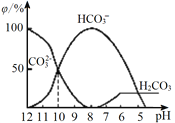
①在同一溶液中,H2CO3、HCO3-、CO32-______(填“能”或“不能”)大量共存。
②当pH =7时,溶液中含碳元素的微粒主要为________。溶液中各种离子的物质的量浓度大小关系为______________。
③反应的CO32-+H2O![]() HCO3-+OH-的平衡常数Kh=______。
HCO3-+OH-的平衡常数Kh=______。
【答案】 631.5 10-9 不变 不能 HCO3- c(Na+)>c(Cl-)>c(HCO3-)>c(H+)=c(OH-) 10-4
【解析】(1)根据N2、O2分子中化学键的键能分别是946kJmol-1、497kJmol-1以及反应N2(g)+O2(g)=2NO(g)△H=+180kJmol-1可设NO分子中化学键的键能为X,则有:946kJmol-1+497kJmol-1-2X=180kJmol-1 得:X=631.5kJmol-1,故答案为:631.5;
(2)CH3COOH为酸,pH=-lgc(H+),pH等于5的CH3COOH溶液中C(H+)=1.0×10-5mol/L,25℃时:Kw=c(OH-)×c(H+)=10-14,溶液中的c(OH-)=![]() =1.0×10-9mol/L,pH等于5的CH3COOH溶液中氢离子来源为乙酸的电离和水的电离,但乙酸溶液中水电离出的氢离子浓度等于氢氧根离子浓度,所以由水电离出的C(H+)是1.0×10-9mol/L,往溶液中加入少量NaOH固体,反应生成醋酸钠,溶液中
=1.0×10-9mol/L,pH等于5的CH3COOH溶液中氢离子来源为乙酸的电离和水的电离,但乙酸溶液中水电离出的氢离子浓度等于氢氧根离子浓度,所以由水电离出的C(H+)是1.0×10-9mol/L,往溶液中加入少量NaOH固体,反应生成醋酸钠,溶液中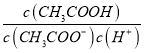 =
=![]() 温度不变电离平衡常数不变,故答案为:1.0×10-9mol/L;不变;
温度不变电离平衡常数不变,故答案为:1.0×10-9mol/L;不变;
(3)常温下在20mL0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,先反应生成碳酸氢钠,再与盐酸反应生成二氧化碳、水。
①由反应及图象可知,在同一溶液中,H2CO3、HCO3-、CO32-不能大量共存,故答案为:不能;
②由图象可知,pH=7时,c(OH-)=c(H+),溶液中含碳元素的主要微粒为HCO3-、H2CO3(少量),电荷守恒可知c(Na+)+c(H+)=c(Cl-)+c(HCO3-)+c(OH-),则c(Na+)>c(Cl-),因HCO3-水解,则c(Na+)>c(Cl-)>c(HCO3-)>c(OH-)=c(H+),故答案为:HCO3-;c(Na+)>c(Cl-)>c(HCO3-)>c(OH-)=c(H+);
③CO32-的水解常数Kh=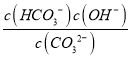 ,当溶液中c(HCO3-):c(CO32-)=1:1时,图象可知pH=10,c(H+)=10-10mol/L,由Kw可知c(OH-)=10-4mol/L,则Kh=
,当溶液中c(HCO3-):c(CO32-)=1:1时,图象可知pH=10,c(H+)=10-10mol/L,由Kw可知c(OH-)=10-4mol/L,则Kh=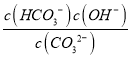 =c(OH-)=10-4mol/L,故答案为:10-4。
=c(OH-)=10-4mol/L,故答案为:10-4。


 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源: 题型:
【题目】下列有关NO2的说法正确的是( )
A.NO2可由N2与O2放电反应直接制备
B.NO2有毒,但因其易溶于水且与水反应,因此不属于大气污染物
C.NO2既有氧化性也有还原性
D.NO2为红棕色气体,因此将NO2通入水中,溶液显红棕色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,体积均为20 mL、浓度均为0.1 mol L-1的两种酸HX、HY分别与0.1 mol L-1的NaOH溶液反应,所加NaOH溶液体积与反应后溶液的-pH的关系如图所示。下列叙述正确的是
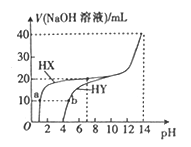
A. a点c(X-)>b点c(Y-) B. HX发生反应的离子方程式为HX+OH-=X-+H2O
C. Ka(HY)的数量级约为10-3 D. pH=7时,两种反应后的溶液中c(Y-)>c(X-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米铜是一种性能优异的超导材料,以辉铜矿(主要成分为Cu2S)为原料制备纳米铜粉的工艺流程如图1所示。

(1)用黄铜矿(主要成分为CuFeS2)、废铜渣和稀硫酸共同作用可获得较纯净的Cu2S,其原理如图2所示,该反应的离子方程式为__________________。
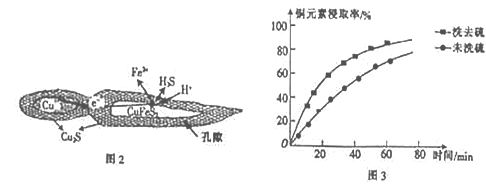
(2)从辉铜矿中浸取铜元素时,可用FeCl3溶液作浸取剂。
①反应:Cu2S+4FeCl3=2CuCl2+4FeCl2+S,每生成1molCuCl2,反应中转移电子的物质的量为______;浸取时,在有氧环境下可维持Fe2+较高浓度,有关反应的离子方程式为________。
②浸取过程中加入洗涤剂溶解硫时,铜元素浸取率的变化如图3 所示,未洗硫时铜元素浸取率较低,其原因是_____________________。
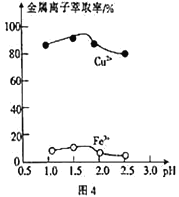
(3)“萃取”时,两种金属离子萃取率与pH的关系如图4 所示,当pH>1.7时,pH越大,金属离子萃取率越低,其中Fe2+萃取率降低的原因是_________________。
(4)用“反萃取”得到的CuSO4溶液制备纳米铜粉时,该反应中还原产物与氧化产物的质量之比为_______________。
(5)在萃取后的“水相”中加入适量氨水,静置,再经过滤、_____、干燥、_____等操作可得到Fe2O3产品。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应最后能产生沉淀的是( )
A.向AlCl3溶液中加过量的NaOH溶液
B.向NaAlO2溶液中加过量的盐酸
C.向AlCl3溶液中通入过量的CO2
D.向NaAlO2溶液中通入过量的CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是 ( )
A. V L a mol/L的氯化铁溶液中,若Fe3+的数目为NA,则Cl-的数目大于3NA
B. 电解精炼铜的过程中,每转移NA个电子时,阳极溶解铜的质量为32g
C. 40gSiC晶体中含有SiC分子的数目为NA
D. 标准状况下,将22.4LNO和11.2LO2混合后,可以得到NA个NO2分子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com