
短周期六元素A、B、C、D、E、F,原子序数依次增大;A、B的阴离子与C、D的阳离子的电子排布式均为ls22s22p6,A原子核外有2个未成对电子,C单质可与热水反应但不能与冷水反应;E、F原子在基态时填充电子的轨道有9个,且E原子核外有3个未成对电子,F能与A形成相同价态的阴离子,且A离子半径小于F离子.回答:
(1)写出各元素的符号:A ;B ;C ;D ;E ;F .
(2)写出B与C形成的化合物的电子式 .
(3)请写出基态原子F的简化电子排布式 .
(4)上述六种元素按电负性从小到大的排列是 (写元素符号).
(5)C、D、E、F元素第一电离能从小到大的排列是 (写元素符号);
(6)A、B、C、D四种元素的简单离子按半径由小到大的顺序为(用离子符号表示) .
(7)C、D、E、F四种元素中,形成的最高价氧化物对应水化物中(写化学式):酸性最强的是 碱性最强的是 .呈两性的是 .
考点:
位置结构性质的相互关系应用.
专题:
元素周期律与元素周期表专题.
分析:
原子序数依次增大的短周期元素A、B、C、D、E、F,A、B的阴离子与C、D的阳离子的电子排布式均为ls22s22p6,A原子核外有2个未成对电子,则A为O,B为F,C单质可与热水反应但不能与冷水反应,则C为Mg,D为Al,E、F原子在基态时填充电子的轨道有9个,且E原子核外有3个未成对电子,则E为P,F能与A形成相同价态的阴离子,且A离子半径小于F离子,则F和O同主族,且在O的下方,故为S,综上所述:A为氧,B为氟,C为镁,D为铝,E为磷,F为硫,据此答题.
解答:
解:原子序数依次增大的短周期元素A、B、C、D、E、F,A、B的阴离子与C、D的阳离子的电子排布式均为ls22s22p6,A原子核外有2个未成对电子,则A为O,B为F,C单质可与热水反应但不能与冷水反应,则C为Mg,D为Al,E、F原子在基态时填充电子的轨道有9个,且E原子核外有3个未成对电子,则E为P,F能与A形成相同价态的阴离子,且A离子半径小于F离子,则F和O同主族,且在O的下方,故为S,综上所述:A为氧,B为氟,C为镁,D为铝,E为磷,F为硫,
(1)由上面的分析可知,A为O;B为F;C为Mg;D为Al;E为P;F为S,
故答案为:O;F;Mg;Al;P;S;
(2)写B与C形成的化合物为氟化镁,它的电子式为 ,
,
故答案为: ;
;
(3)F为硫,它的简化电子排布式为:[Ne]3s23p4,
故答案为:[Ne]3s23p4;
(4)根据元素周期律,同周期元素从左向右电负性增大,同主族元素从上向下,电负性减弱,所以六种元素按电负性从小到大的排列是Mg<Al<P<S<O<F,故答案为:Mg<Al<P<S<O<F;
(5)Mg、Al、P、S元素第一电离取决于金属性的强弱,金属性越强,第一电离能越小,但是由于铝核外本来是3s23p1,失去一个电子后,核外电子变成 3s2 这是一种稳定的结构,所以铝失去第一个电子比镁要容易,
故答案为:Al<Mg<S<P;
(6)O、F、Mg、Al四种元素的简单离子,最外层电子排布相同,由于原子序数越小,对外层电子的吸引能力越弱,故原子序数越小,半径越大,故按半径由小到大的顺序为:Al3+<Mg2+<F﹣<O2﹣,
故答案为:Al3+<Mg2+<F﹣<O2﹣;
(7)元素的金属性越强,元素的最高价氧化物对应水化物的碱性越强,元素的非金属性越强,元素的最高价氧化物对应水化物的酸性越强,所以在C、D、E、F四种元素中,形成的最高价氧化物对应水化物中,酸性最强的是H2SO4,碱性最强的是 Mg(OH)2,呈两性的是Al(OH)3,
故答案为:H2SO4;Mg(OH)2;Al(OH)3;
点评:
本题主要考查了电子式、电子排布式、元素周期律等知识点,中等难度,元素推断是解题的关键,答题时注意元素周期律的灵活运用.


科目:高中化学 来源: 题型:
从Cu、O2、NaOH、盐酸、CaCO3、NaNO3、CaO、AgNO3八种物质中选出合适的,按要求各写出一个方程式.
(1)化合反应 (化学方程式)
(2)分解反应 (化学方程式)
(3)置换反应 (离子方程式)
(4)有气体放出的复分解反应 (离子方程式)
(5)有沉淀生成的复分解反应 (离子方程式)
查看答案和解析>>
科目:高中化学 来源: 题型:
为验证淀粉水解可生成还原性糖,进行了下列实验,该实验中操作步骤的排列顺序正确的是( )
①取少量淀粉加水制成溶液; ②加热煮沸; ③加入新制的Cu(OH)2悬浊液; ④加入几滴稀H2SO4;⑤加热; ⑥加入碱液中和并呈碱性.
|
| A. | ①④⑤⑥③② | B. | ⑤④②③①⑥ | C. | ①④②③⑤⑥ | D. | ①⑤③④⑥② |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列文字表述与反应方程式对应且正确的是( )
|
| A. | 用浓硫酸与4﹣溴﹣1﹣丁醇加热发生消去反应:BrCH2CH2CH2CH2OH |
|
| B. | 羟基乙酸催化缩聚得PGA:nHOCH2COOH |
|
| C. | 水杨酸( |
|
| D. | 丙烯与HCl加成产物可生成两种有机物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
NA为阿伏伽德罗常数的值。下列叙述正确的是( )
A.常温下将28 g Fe投人到足量的浓硝酸中,可得到标准状况下33.6 L NO2
B.任何条件下,64 gSO2中含有的原子数目一定为3 NA
C.25℃时pH =13的NaOH溶液中含有OH一的数目为0. 1 NA
D.1 mo1 Na2O2反应生成O2时,必失去2 NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示。下列说法不正确的是( )
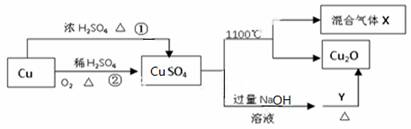
A.CuSO4在1100℃分解所得气体X可能是SO2和SO3的混合气体
B.Y可以是葡萄糖溶液
C.相对于途径①,途径②更好地体现了绿色化学思想
D.将CuSO4溶液蒸发浓缩,冷却结晶可制得胆矾晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.能使pH试纸呈红色的溶液中可能大量存在以下离子:Na+、NH4+、I一、NO3-
B.将CH3 COOH溶液和NaOH溶液等体积混合,该溶液中一定存在的关系式为:
c( Na+)=c(CH3 COO一)+c(CH3COOH)
C.CuSO4溶液遇到闪锌矿(ZnS)慢慢转化为铜蓝(CuS),是因为ZnS的溶解度大于CuS
D.0.1mol/LNaHSO3溶液,其pH =3,该溶液中的粒子浓度大小为:
c( Na+)>c( HSO3一)>c(SO32一)>c(H2SO3)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
下图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物。
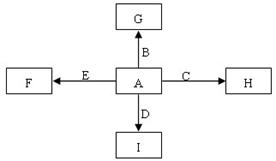
已知:
① 反应 能放出大量的热,该反应曾应用于铁轨的焊接;
能放出大量的热,该反应曾应用于铁轨的焊接;
② I是一种常见的温室气体,它和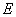 可以发生反应:2E+I
可以发生反应:2E+I 2F+D,F中的E元素的质量分数为60%.
2F+D,F中的E元素的质量分数为60%.
回答问题:
(1)①中反应的化学方程式为____________________________________________;
(2)化合物Ⅰ的电子式为______________________,它的空间构型是_________;
(3)1.6g G 溶于盐酸,得到的溶液与铜粉完全反应,计算至少所需铜粉的质量(写出离子方 程式和计算过程);
程式和计算过程);
(4)C与过量NaOH溶液反应的离子方程式为___________________________,反应后溶液与过量化合物Ⅰ反应的离子方程式为_______________________________;
(5)E在I中燃烧观察到的现象是__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com