
【题目】利用如下实验探究铁钉在不同溶液中的吸氧腐蚀。
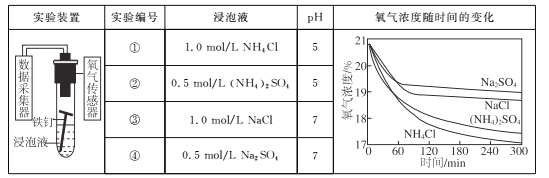
下列说法不正确的是
A. 上述正极反应均为O2+4e-+2H2O=4OH-
B. 在不同溶液中,Cl是影响吸氧腐蚀速率的主要因素
C. 向实验④中加入少量(NH4)2SO4固体,吸氧腐蚀速率加快
D. 在300 min内,铁钉的平均吸氧腐蚀速率酸性溶液大于中性溶液
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源: 题型:
【题目】电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+氧化成Co3+ , 然后Co3+将甲醇氧化成CO2和H+(用石墨烯吸附除去Co2+).现用如图装置模拟上述过程,则: 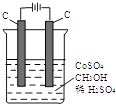
Co2+在阳极的电极反应式为:;除去甲醇的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修3:物质结构与性质]某硅酸盐研究所在硅酸盐材料和闪烁晶体等领域研究上取得了重大的成就。
(1)SiO44-是构成硅酸盐的基本结构单元,通过共用氧相连可形成硅氧组群。
①基态硅原子价电子排布图是________。
②与SiO44-互为等电子体的微粒符号是______(任写一种)。
③下图为一种硅氧组群的结构示意图,其离子符号为______,其中Si原子的杂化方式为____。
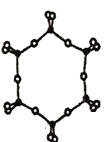
④电负性:Si______O(填“>”、“=”或“<”) 。
(2)钨酸铅(PWO)是一种闪烁晶体,晶胞结构如图所示。
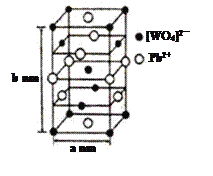
①PWO中钨酸根结构式式为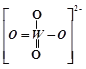 ,该离子中δ键和π键的个数比是______。
,该离子中δ键和π键的个数比是______。
②PWO晶体中含有的微粒间作用力是______(填标号)。
A.范德华力 B.离子键
C.共价键 D.金属键
③己知晶体的摩尔质量为Mg·mol-1,则该晶体的密度d=_______g·cm-3。(阿伏加德罗常数用NA表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E5种微粒,它们可能是原子或离子,并且组成它们的元素的原子序数都小于18。A微粒的最外层电子数比次外层多5个;金属原子B的原子核内质子数比前一周期的同族元素多8个,其单质不能从CuSO4溶液中置换出Cu;C元素有3种同位素:C1、C2、C3,C1的质量数分别为C2、C3的![]() 和
和![]() ;D元素的气态氢化物溶于水后显碱性;E是由两种不同元素组成的带负电荷的微粒,它共有2个原子核10个电子,E极易与C+结合成中性微粒。
;D元素的气态氢化物溶于水后显碱性;E是由两种不同元素组成的带负电荷的微粒,它共有2个原子核10个电子,E极易与C+结合成中性微粒。
(1)写出五种微粒的表示符号:A________、B________、C________、D________、E________。
(2)写出C的同位素名称:C1________、C2________、C3________。
(3)C和D形成的10个电子的分子的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 石墨烯是烃类,属于分子晶体
B. 苯的结构特殊,分子中既没有单键也没有双键
C. 邻二甲苯只有一种结构,说明苯中所有碳碳键相同
D. 石油的分馏和煤的液化都是发生了物理变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用钒钛磁铁矿为原料冶炼铁,产生一种固体废料,主要成分如下表。

通过下列工艺流程可以实现元素Ti、Al、Si的回收利用,并得到纳米二氧化钛和分子筛。

请回答下列问题:
(1)步骤①②③中进行分离操作的名称是____,
(2)下列固体废料的成分中,不属于碱性氧化物的是____(填字母序号)。
a. TiO2 b.MgO c.SiO2 d.CaO
(3)熔融温度和钛的提取率关系如下图,适宜温度为500℃,理由是____。

(4)滤液①中溶质的成分是____。
(5)步骤②中发生反应的离子方程式是 ___。
(6)将步骤③中制取分子筛的化学方程式补充完整:______
![]()
根据成分表中数据,计算10 kg固体废料,理论上应再加入Na2 Si03物质的量的计算式是n( Na2SiO3)=____mol(摩尔质量/g/mol :SiO2 60 Al2O3 102)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯的原子序数为17,35Cl是氯的一种同位素,下列说法不正确的是( )
A.35Cl原子所含质子数为18
B.35Cl2气体的摩尔质量为70
C.3.5g的35Cl2气体的体积为2.24L
D.1/18mol的H35Cl分子所含中子数约为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是元素周期表的一部分。按要求填写下列空白:
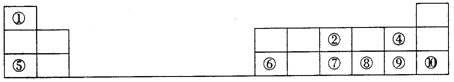
(1)元素⑦在周期表中的位置可表示为_______。
(2)①~⑩元素的最高价氧化物对应的水化物中,酸性最强的是_______ (填化学式)。
(3)④⑧⑨三种元素形成的气态氢化物稳定性由大到小的顺序是_______(用化学式表示)。
(4)⑤和⑥两种元素的最高价氧化物对应的水化物反应的离子方程式为_______。
(5)为了证明⑤和⑥两种元素的金属性强弱,下列说法或实验能提供证据的是_______。
A.比较两种元素的单质的熔点、沸点高低
B.将两种元素的单质分别与冷水反应,观察反应的剧烈程度
C.比较两种元素的最高价氧化物对应的水化物的碱性强弱
(6)铁元素处在周期表第四周期第Ⅷ族,它在地壳中含量仅次于铝。全世界每年都有大量的钢铁因生锈而损失。钢铁发生电化学腐蚀时,负极反应是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com