
 .
. .②I→G 的化学方程式
.②I→G 的化学方程式 .
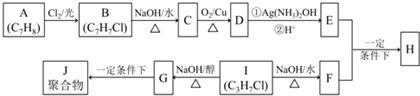
.分析 A属于芳香烃,分子式为C7H8,则A为 ,B与氯气在光照条件下发生甲基上取代反应生成B,结合B的分子式可知B为
,B与氯气在光照条件下发生甲基上取代反应生成B,结合B的分子式可知B为 ,B发生水解反应生成C为
,B发生水解反应生成C为 ,C发生催化氧化生成D为
,C发生催化氧化生成D为 ,D与银氨溶液反应、酸化得到E为
,D与银氨溶液反应、酸化得到E为 .I的分子式为C3H7Cl,核磁共振氢谱为二组峰,且峰的面积比为6:1,则I为CH3CHClCH3,I发生水解反应得到F为CH3CH(OH)CH3,E与F发生酯化反应生成H为
.I的分子式为C3H7Cl,核磁共振氢谱为二组峰,且峰的面积比为6:1,则I为CH3CHClCH3,I发生水解反应得到F为CH3CH(OH)CH3,E与F发生酯化反应生成H为 .I发生消去反应生成G为CH2=CHCH3,G发生加聚反应生成J为
.I发生消去反应生成G为CH2=CHCH3,G发生加聚反应生成J为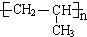 .
.
解答 解:A属于芳香烃,分子式为C7H8,则A为 ,B与氯气在光照条件下发生甲基上取代反应生成B,结合B的分子式可知B为
,B与氯气在光照条件下发生甲基上取代反应生成B,结合B的分子式可知B为 ,B发生水解反应生成C为
,B发生水解反应生成C为 ,C发生催化氧化生成D为
,C发生催化氧化生成D为 ,D与银氨溶液反应、酸化得到E为
,D与银氨溶液反应、酸化得到E为 .I的分子式为C3H7Cl,核磁共振氢谱为二组峰,且峰的面积比为6:1,则I为CH3CHClCH3,I发生水解反应得到F为CH3CH(OH)CH3,E与F发生酯化反应生成H为
.I的分子式为C3H7Cl,核磁共振氢谱为二组峰,且峰的面积比为6:1,则I为CH3CHClCH3,I发生水解反应得到F为CH3CH(OH)CH3,E与F发生酯化反应生成H为 .I发生消去反应生成G为CH2=CHCH3,G发生加聚反应生成J为
.I发生消去反应生成G为CH2=CHCH3,G发生加聚反应生成J为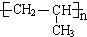 .
.
(1)通过以上分析知,E为 ,含有官能团为羧基,B结构简式为
,含有官能团为羧基,B结构简式为 ,
,
故答案为:羧基; ;
;
(2)B→C和G→J两步的反应类型分别为取代反应、加聚反应,
故答案为:取代反应;加聚反应;
(3)①E+F→H的化学方程式为: ,
,
②I→G 的化学方程式: ,
,
故答案为: ;
; ;
;
(4)I(CH3CHClCH3)的同系物K比I相对分子质量大28,则K的分子式为C5H11Cl,
①可以看作C5H12被取代产物,正戊烷被取代有3种,异戊烷被取代有4种,新戊烷被取代有1种,故K的同分异构体有8种,
故答案为:8;
②若K不能发生消去反应,则K的结构简式为(CH3)3CCH2Cl,
故答案为:(CH3)3CCH2Cl.
点评 本题考查有机物推断,根据物质分子式、反应条件、题给信息进行推断,熟练掌握官能团的性质与转化,侧重考查学生分析推理能力,题目难度中等.


科目:高中化学 来源: 题型:实验题
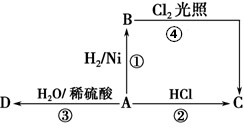
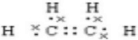 ;D的结构简式为CH3CH2OH.
;D的结构简式为CH3CH2OH.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K2FeO4是新型水处理剂,其原理与明矾相同 | |
| B. | 煤的气化是物理变化,是高效、清洁地利用煤的重要途径 | |
| C. | 硫酸亚铁片和维生素C同时服用,能增强治疗缺铁性贫血的效果 | |
| D. | 纯银器在空气中久置变黑是因为发生了电化学腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |

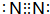 ;⑨的过氧化物
;⑨的过氧化物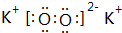 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴乙烷(乙醇):多次加水振荡,分液,弃水层 | |
| B. | 苯(苯酚):加溴水,振荡,过滤除去沉淀 | |
| C. | 溴苯(溴单质):加NaOH溶液振荡,分液,弃水层 | |
| D. | 乙酸乙酯(乙酸):加饱和碳酸钠溶液,充分振荡,分液,弃水层 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
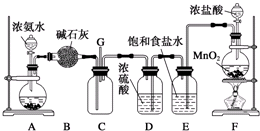
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
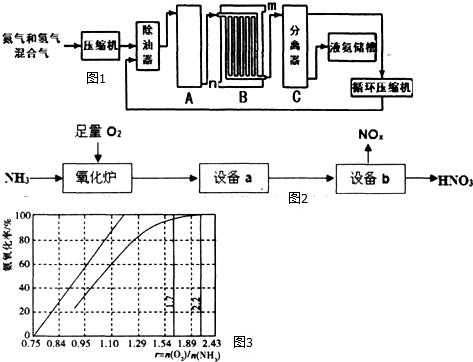
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 单质 | a | b | c | d | e |
| 沸点(℃) | 58.8 | 882.9 | 444.7 | 2 355 | 1 107 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com