
¹¤ŅµŗĻ³É°±µÄ·“Ó¦ĪŖ£ŗN2(g)+3H2(g) 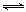 2NH3(g) ”÷H <0
2NH3(g) ”÷H <0
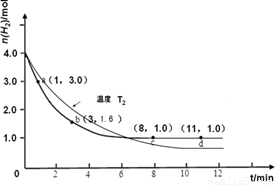
ijŹµŃ齫3.0 mol N2(g)ŗĶ4. 0 mol H2(g)³äČėČŻ»żĪŖ10LµÄĆܱÕČŻĘ÷ÖŠ£¬ŌŚĪĀ¶ČT1ĻĀ·“Ó¦”£²āµĆH2µÄĪļÖŹµÄĮæĖę·“Ó¦Ź±¼äµÄ±ä»ÆČēĻĀĶ¼ĖłŹ¾”£
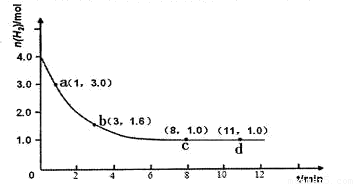
£Ø1£©·“Ó¦æŖŹ¼3minÄŚ£¬H2µÄĘ½¾ł·“Ó¦ĖŁĀŹĪŖ ”£
£Ø2£©¼ĘĖćøĆĢõ¼žĻĀŗĻ³É°±·“Ó¦µÄ»ÆŃ§Ę½ŗā³£Źż£ØŠ“³ö¼ĘĖć¹ż³Ģ£¬½į¹ū±£Įō2Ī»ÓŠŠ§Źż×Ö£©”£
£Ø3£©½öøıäĪĀ¶ČĪŖT2 ( T2Š”ÓŚTI£©ŌŁ½ųŠŠŹµŃ飬ĒėŌŚ“šĢāæØæņĶ¼ÖŠ»³öH2µÄĪļÖŹµÄĮæĖę·“Ó¦Ź±¼ä±ä»ÆµÄŌ¤ĘŚ½į¹ūŹ¾ŅāĶ¼”£
£Ø4£©ŌŚŅŌĆŗĪŖÖ÷ŅŖŌĮĻµÄŗĻ³É°±¹¤ŅµÖŠ£¬ŌĮĻĘųĒāĘų³£ÓĆĻĀŹö·½·Ø»ńµĆ£ŗ
¢ŁC+H2O(g)
 CO+H2£»¢ŚCO+H2O(g)
CO+H2£»¢ŚCO+H2O(g)  CO2+H2£»
CO2+H2£»
ŅŃÖŖ£ŗCO(g)+1/2O2(g)=CO2(g) ”÷H=”Ŗ283.0kJ/mol
H2(g)+1/2O2(g)=H2O(g) ”÷H=”Ŗ241.8kJ/mol
Š“³öÉĻŹöCOÓėH2O(g)·“Ó¦µÄČČ»Æѧ·½³ĢŹ½£ŗ ”£
£Ø5£©ŗĻ³É°±¹¤ŅµÖŠ£¬ŌĮĻĘų(N2”¢H2»ģÓŠÉŁĮæCO”¢NH3£©ŌŚ½ųČėŗĻ³ÉĖžÖ®Ē°£¬ÓĆ“×Ėį¶ž°±ŗĻĶ£ØI£©ČÜŅŗĄ“ĪüŹÕCO£¬Ęä·“Ó¦ĪŖ£ŗ
CH3COO[Cu(NH3)2]+CO+NH3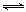 CH3COO[Cu(NH3)3]•CO
”÷H<0
CH3COO[Cu(NH3)3]•CO
”÷H<0
Š“³öĢįøßCOĪüŹÕĀŹµÄĘäÖŠŅ»Ļī“ėŹ©£ŗ ”£
£Ø16·Ö£©
£Ø1£©0.080mol/(L”¤min) £Ø3·Ö£¬µ„Ī»”¢ÓŠŠ§Źż×Ö“ķĀ©ŗĻæŪ1·Ö£©
£Ø2£©£Ø¹²5·Ö£©½ā£ŗŅĄĢāŅā£¬Ę½ŗāŹ±H2µÄÅضČĪŖ0.10 mol/L
N2(g) + 3H2(g)
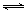 2NH3(g)
2NH3(g)
ĘšŹ¼ÅØ¶Č£Ømol/L£© 0.30 0.40 0
×Ŗ»ÆÅØ¶Č£Ømol/L£© 0.10 0.30 0.20
Ę½ŗāÅØ¶Č£Ømol/L£© 0.20 0.10 0.20 £Ø1·Ö£©
K=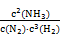 =
=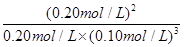 =2.0”Į102
(L/mol)2
=2.0”Į102
(L/mol)2
“š£ŗøĆĢõ¼žĻĀŗĻ³É°±·“Ó¦µÄ»ÆŃ§Ę½ŗā³£ŹżĪŖ2.0”Į102 (L/mol)2”£
£Ø4·Ö£¬ĘäÖŠ“śČė¹«Ź½”¢“śČėŹżÖµø÷1·Ö£»½į¹ū2·Ö£¬“śČėŹżÖµ²»“ųµ„Ī»»ņµ„Ī»”¢ÓŠŠ§Źż×Ö“ķĪóŗĻæŪ1·Ö£¬ KÖµ²»“ųµ„Ī»²»æŪ·Ö£©
£Ø3£©£Ø2·Ö£¬×¢ŅāĒśĻßĘšµć”¢Š±ĀŹ”¢Ę½ŗāµć£Øt>8min,n(H2)<1.0mol£©ŅŖĖŲÓŠ“ķ£¬ĆæøöŅŖĖŲæŪ1·ÖÖ±ÖĮ0·Ö£¬²»±ź×¢ĪĀ¶Č²»æŪ·Ö£©
£Ø4£©CO(g)+H2O(g)=CO2(g)+H2(g) ”÷H=”Ŗ41.2 kJ/mol
£Ø4·Ö£¬×“Ģ¬“ķĀ©øĆŠ”Ģā0·Ö£¬ĘäÖŠ£ŗ·½³ĢŹ½2·Ö£¬¦¤H 2·Ö£¬“ķĀ©µ„Ī»æŪ1·Ö”£ĘäĖū¼ĘĮæŹż£¬ŗĻĄķ¼“øų·Ö£©
£Ø5£©øßŃ¹£¬µĶĪĀ£¬¼ÓČėÅØ°±Ė® £¬Ōö“ó“×Ėį¶ž°±ŗĻĶ(¢ń)ČÜŅŗÅØ¶Č£¬¼°Ź±·ÖĄėCH3COO[Cu(NH3)3]”¤COµČČĪŠ“Ņ»µć£¬ÓĆ“ß»Æ¼Į²»øų·Ö£Ø2·Ö£¬ŗĻĄķ¼“øų·Ö£©
”¾½āĪö”æ
ŹŌĢā·ÖĪö£ŗ£Ø1£©¶ĮĶ¼£¬ĘšŹ¼Ź±ĒāĘųĪŖ4.0mol£¬3minŹ±ĒāĘųĪŖ1.6mol£¬ÓÉÓŚČŻĘ÷ČŻ»żĪŖ10L£¬ŌņĒāĘųµÄ±ä»ÆÅضČĪŖ(
4.0mol”Ŗ1.6mol)/10L=0.24mol/L£¬Ōņv(H2)=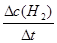 =
= = 0.080mol/(L•min)£»£Ø2£©½ā£ŗŅĄĢāŅā£¬ĘšŹ¼”¢Ę½ŗāŹ±H2µÄÅØ¶Č·Ö±šĪŖ0.30mol/L”¢0.10 mol/LŌņ£ŗ
= 0.080mol/(L•min)£»£Ø2£©½ā£ŗŅĄĢāŅā£¬ĘšŹ¼”¢Ę½ŗāŹ±H2µÄÅØ¶Č·Ö±šĪŖ0.30mol/L”¢0.10 mol/LŌņ£ŗ
N2(g) + 3H2(g) 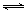 2NH3(g)
2NH3(g)
ĘšŹ¼ÅØ¶Č£Ømol/L£© 0.30 0.40 0
×Ŗ»ÆÅØ¶Č£Ømol/L£© 0.10 0.30 0.20
Ę½ŗāÅØ¶Č£Ømol/L£© 0.20 0.10 0.20
K£½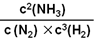 =
=
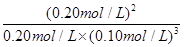 =
2.0”Į102 (L/mol)2
=
2.0”Į102 (L/mol)2
“š£ŗøĆĢõ¼žĻĀŗĻ³É°±·“Ó¦µÄ»ÆŃ§Ę½ŗā³£ŹżĪŖ2.0”Į102 (L/mol)2”£
£Ø3£©»Ķ¼ŅŖµć£ŗ¢ŁT1”śT2£¬½µµĶĪĀ¶Č£¬Ōņ·“Ó¦ĖŁĀŹ¼õŠ”£¬µ„Ī»Ź±¼äÄŚĻūŗÄĒāĘųµÄĪļÖŹµÄĮæ¼õŠ”£¬“ļµ½Ę½ŗāŹ±¼äŌö“󣻢ŚÓÉÓŚÕż·“Ó¦ŹĒ·ÅČČ·“Ó¦£¬½µµĶĪĀ¶ČĘ½ŗāĻņÕż·“Ó¦·½ĻņŅĘ¶Æ£¬ŌņĘ½ŗāŹ±ĒāĘųµÄĪļÖŹµÄĮæ¼õŠ”£»£Ø4£©øł¾ŻøĒĖ¹¶ØĀÉ£¬µŚŅ»øöČČ»Æѧ·½³ĢŹ½¼õČ„µŚ¶žøöČČ»Æѧ·½³ĢŹ½£¬ŌņCO(g)+H2O(g)=CO2(g)+H2(g) ”÷H=”Ŗ41.2
kJ/mol£»£Ø5£©ÓÉÓŚCH3COO[Cu(NH3)2]+CO+NH3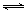 CH3COO[Cu(NH3)3]•COµÄÕż·“Ó¦ŹĒĘųĢåĢå»ż¼õŠ”µÄ·ÅČČ·“Ó¦£¬Ņņ“ĖŌö“ó“×Ėį¶ž°±ŗĶĶ£ØI£©ČÜŅŗÅØ¶Č»ņÕß¼ÓČėÅØ°±Ė®£¬¼°Ź±·ÖĄėCH3COO[Cu(NH3)3]•CO£¬Ōö“óŃ¹Ē攢½µµĶĪĀ¶ČµČ“ėŹ©£¬¶¼ÄÜŹ¹Ę½ŗāĻņÕż·“Ó¦·½ĻņŅĘ¶Æ£¬ĢįøßCOµÄĪüŹÕĀŹ»ņ×Ŗ»ÆĀŹ”£
CH3COO[Cu(NH3)3]•COµÄÕż·“Ó¦ŹĒĘųĢåĢå»ż¼õŠ”µÄ·ÅČČ·“Ó¦£¬Ņņ“ĖŌö“ó“×Ėį¶ž°±ŗĶĶ£ØI£©ČÜŅŗÅØ¶Č»ņÕß¼ÓČėÅØ°±Ė®£¬¼°Ź±·ÖĄėCH3COO[Cu(NH3)3]•CO£¬Ōö“óŃ¹Ē攢½µµĶĪĀ¶ČµČ“ėŹ©£¬¶¼ÄÜŹ¹Ę½ŗāĻņÕż·“Ó¦·½ĻņŅĘ¶Æ£¬ĢįøßCOµÄĪüŹÕĀŹ»ņ×Ŗ»ÆĀŹ”£
æ¼µć£ŗæ¼²é»Æѧ·“Ó¦ŌĄķ£¬Éę¼°Ę½¾ł·“Ó¦ĖŁĀŹµÄ¼ĘĖć”¢»ÆŃ§Ę½ŗā³£ŹżµÄ¼ĘĖć¹ż³Ģ”¢»³öĪĀ¶Č¶Ō»Æѧ·“Ó¦ĖŁĀŹŗĶĘ½ŗāŅĘ¶ÆµÄÓ°ĻģĶ¼Ļń”¢øĒĖ¹¶ØĀÉ”¢ČČ»Æѧ·½³ĢŹ½µÄŹéŠ“”¢Ģįøß·“Ó¦Īļ×Ŗ»ÆĀŹµÄ“ėŹ©µČ”£


 ŌĶĮæģ³µĻµĮŠ“š°ø
ŌĶĮæģ³µĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŌĶĮĄķ½ā

| ||
| øßĪĀ |
| ||
| øßĪĀ |
| 4 |
| 7 |
| ||
| øßĪĀ |
| T/”ę | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŌĶĮĄķ½ā

 £Ø1£©Š“³öÉč±øA”¢BµÄĆū³Ę£ŗA
£Ø1£©Š“³öÉč±øA”¢BµÄĆū³Ę£ŗA²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŌĶĮĄķ½ā
| T/K | 303 | 313 | 323 | 353 |
| NH3Éś³ÉĮæ/£Ø10-6 mol£© | 4.8 | 5.9 | 6.0 | 2.0 |
| 3 |
| 2 |
| 4 |
| 7 |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com