
”¾ĢāÄæ”涔¶žĶŖėæ![]() ŹĒ¼ģŃéNi2+µÄĮéĆōŹŌ¼Į”£
ŹĒ¼ģŃéNi2+µÄĮéĆōŹŌ¼Į”£

£Ø1£©Ni2+»łĢ¬ŗĖĶāµē×ÓÅŲ¼Ź½ĪŖ ”£¶”¶žĶŖėæ·Ö×ÓÖŠCŌ×Ó¹ģµĄŌÓ»ÆĄąŠĶĪŖ £¬1mol¶”¶žĶŖėæ·Ö×ÓĖłŗ¬![]() ¼üµÄŹżÄæĪŖ ”£
¼üµÄŹżÄæĪŖ ”£
£Ø2£©NiÄÜÓėCOŠĪ³ÉĖÄōŹ»łÄų[Ni(CO)4]£¬ĖÄōŹ»łÄųČŪµć£19.3”ę£¬·Šµć42.1”ę£¬Ņ×ČÜÓŚÓŠ»śČܼĮ”£
¢ŁNi(CO)4¹ĢĢ¬Ź±ŹōÓŚ ¾§Ģå(Ģī¾§ĢåĄąŠĶ)”£
¢ŚÓėCO»„ĪŖµČµē×ÓĢåµÄŅõĄė×ÓĪŖ (Ģī»ÆѧŹ½)”£
£Ø3£©Ni2+ÓėMg2+”¢O2”ŖŠĪ³É¾§ĢåµÄ¾§°ū½į¹¹ČēĶ¼ĖłŹ¾(Ni2+Ī“»³ö)£¬ŌņøĆ¾§ĢåµÄ»ÆѧŹ½ĪŖ ”£
”¾“š°ø”æ[Ar]3d8 sp2 sp3 15NA CN- Mg2NiO3
”¾½āĪö”æ
ŹŌĢā·ÖĪö£ŗ£Ø1£©NiŹĒ28ŗÅŌŖĖŲ£¬øł¾ŻŌ×ÓŗĖĶāµē×ÓÅŲ¼¹ęĀÉæÉÖŖ£¬Ni2+µÄ»łĢ¬ŗĖĶāµē×ÓÅŲ¼Ź½ĪŖ[Ar]3d8£¬¼×»łÉĻĢ¼Ō×Ó¼Ū²ćµē×Ó¶ŌøöŹżŹĒ4ĒŅ²»ŗ¬¹Āµē×Ó¶Ō£¬ĪŖsp3Ōӻƣ¬Į¬½Ó¼×»łµÄĢ¼Ō×Óŗ¬ÓŠ3øö¼Ū²ćµē×Ó¶ŌĒŅ²»ŗ¬¹Āµē×Ó¶Ō£¬ĪŖsp2Ōӻƣ¬ŅŃÖŖ¶”¶žĶŖėæµÄ½į¹¹Ź½ĪŖ![]() £¬·Ö×ÓÖŠŗ¬ÓŠ13øöµ„¼ü£¬ŗĶ2øöĖ«¼ü£¬Ōņ¹²ŗ¬ÓŠ15øö¦Ņ¼ü£¬ĖłŅŌ1mol¶”¶žĶŖėæŗ¬ÓŠ¦Ņ¼üŹżÄæĪŖ15NA£»
£¬·Ö×ÓÖŠŗ¬ÓŠ13øöµ„¼ü£¬ŗĶ2øöĖ«¼ü£¬Ōņ¹²ŗ¬ÓŠ15øö¦Ņ¼ü£¬ĖłŅŌ1mol¶”¶žĶŖėæŗ¬ÓŠ¦Ņ¼üŹżÄæĪŖ15NA£»
£Ø2£©¢Ł·Ö×Ó¾§ĢåµÄČŪ·Šµć½ĻµĶ£¬ĖÄōŹ»łÄųČŪµć-19.3”ę£¬·Šµć42.1”ę£¬ĖłŅŌøĆĪļÖŹĪŖ·Ö×Ó¾§Ģ壻
¢ŚÓɵŚ¶žÖÜĘŚÖ÷×åŌŖĖŲ×é³ÉµÄĒŅÓėCO»„ĪŖµČµē×ÓĢåµÄŅõĄė×ÓĪŖCN-£»
£Ø3£©ŃõĄė×ÓĪ»ÓŚøĆ¾§°ūµÄĄāÉĻ£¬ŃõĄė×ÓøöŹż=1/4”Į12=3£¬ĖłŅŌøĆ¾§°ūŗ¬ÓŠ3øöŃõĄė×Ó£»Ć¾Ąė×Ó“¦ŌŚĆęÉĻ£¬Ć¾Ąė×ÓøöŹż=1/2”Į4=2£¬øĆ¾§°ūÖŠŗ¬ÓŠ2øöĆ¾Ąė×Ó£¬øł¾Ż»ÆѧŹ½ÖŠŌŖĖŲ»ÆŗĻ¼Ū“śŹżŗĶĪŖĮć£¬øĆ¾§°ūÖŠŗ¬ÓŠ1øöNi£¬ĖłŅŌøĆ¾§°ūµÄ»ÆѧŹ½ĪŖMg2NiO3”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ2015ÄźÅµ±“¶ūÉśĄķѧ»ņŅ½Ń§½±ŹŚÓčÖŠ¹śŅ©Ń§¼ŅĶĄßĻßĻŅŌ¼°°®¶ūĄ¼æĘѧ¼ŅĶžĮ®”¤æ²±“¶ūŗĶČÕ±¾æĘѧ¼Ņ“ó“åÖĒ£¬±ķÕĆĖūĆĒŌŚ¼ÄÉś³ę¼²²”ÖĪĮĘŃŠ¾æ·½ĆęČ”µĆµÄ³É¾Ķ”£ĶĄßĻßĻĻČĒżŠŌµŲ·¢ĻÖĮĖĒąŻļĖŲ£¬æŖ““ĮĖű¼²ÖĪĮĘŠĀ·½·Ø”£ÓŅĶ¼ĪŖĒąŻļĖŲ£¬¹ŲÓŚøĆĪļÖŹµÄĻĀĮŠĖµ·ØÕżČ·µÄŹĒ

A£®ĒąŻļĖŲ»ÆѧŹ½ĪŖC15H20O5
B£®ŌŚ¹āÕÕĢõ¼žĻĀæÉÄÜ·¢ÉśČ”“ś·“Ó¦
C£®æÉŅŌÓėĒāĘų·¢Éś¼Ó³É·“Ó¦
D£®Ė®½žĒąŻļ¶ŌÖĪĮĘű¼²ÓŠĮ¼ŗƵÄĮĘŠ§
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”放»Æѧ”ŖŃ”ŠŽ5ÓŠ»ś»Æѧ»ł“””æ
½Ŗ»ĘĖŲ¾ßÓŠæ¹Ķ»±äŗĶŌ¤·ĄÖ×ĮöµÄ×÷ÓĆ£¬ĘäŗĻ³ÉĀ·ĻßČēĻĀ£ŗ

ŅŃÖŖ£ŗ
i£®1 mol G×ī¶ąÄÜĻūŗÄNa”¢NaOH”¢NaHCO3µÄĪļÖŹµÄĮæ·Ö±šĪŖ3 mol”¢2 mol”¢1 mol”£
ii£®![]()
iii£® £ØR1”¢R2”¢R3ĪŖĢž»ł»ņĒāŌ×Ó£© Ēė»Ų“š£ŗ
£ØR1”¢R2”¢R3ĪŖĢž»ł»ņĒāŌ×Ó£© Ēė»Ų“š£ŗ
£Ø1£©B”śCµÄ·“Ó¦ĄąŠĶŹĒ ”£
£Ø2£©C”śD·“Ó¦µÄ»Æѧ·½³ĢŹ½ŹĒ ”£
£Ø3£©EµÄŗĖ“Ź²ÕńĒāĘ×ÖŠÓŠĮ½øö·å£¬EÖŠŗ¬ÓŠµÄ¹ŁÄÜĶÅĆū³ĘŹĒ ”£
E”śG·“Ó¦µÄ»Æѧ·½³ĢŹ½ŹĒ ”£
£Ø4£©ĻĀĮŠÓŠ¹ŲĻćĄ¼Č©µÄŠšŹö²»ÕżČ·µÄŹĒ ”£
a£®ĻćĄ¼Č©ÄÜÓėNaHCO3ČÜŅŗ·“Ó¦
b£®ĻćĄ¼Č©ÄÜÓėÅØäåĖ®·¢ÉśČ”“ś·“Ó¦
c£®1 molĻćĄ¼Č©×ī¶ąÄÜÓė3 molH2·¢Éś¼Ó³É·“Ó¦
£Ø5£©Š“³öŅ»ÖÖ·ūŗĻĻĀĮŠĢõ¼žµÄĻćĄ¼Č©µÄĶ¬·ÖŅģ¹¹ĢåµÄ½į¹¹¼ņŹ½ ”£
¢Ł±½»·ÉĻµÄŅ»Ļõ»łČ”“śĪļÓŠ2ÖÖ
¢Ś1 moløĆĪļÖŹĖ®½ā£¬×ī¶ąĻūŗÄ3 molNaOH
£Ø6£©½Ŗ»ĘĖŲµÄ·Ö×ÓÖŠÓŠ2øö¼×»ł£¬Ęä½į¹¹¼ņŹ½ŹĒ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ¶ĢÖÜĘŚŌŖĖŲX”¢Y”¢Z”¢WµÄŌ×ÓŠņŹżŅĄ“ĪŌö“ó£¬XµÄŌ×Ó°ė¾¶±ČYŠ”£¬XÓėWĶ¬Ö÷×壬ZŹĒµŲæĒÖŠŗ¬Įæ×īøßµÄŌŖĖŲ”£X”¢Y”¢Z”¢WŌ×Ó×īĶā²ćµē×ÓŹżÖ®ŗĶĪŖ13”£ĪŹ£ŗ
£Ø1£©XŹĒ YŹĒ ZŹĒ WŹĒ £ØĢīŌŖĖŲ·ūŗÅ£©
£Ø2£©Š“³öWµÄ×īøß¼ŪŃõ»ÆĪļ¶ŌÓ¦µÄĖ®»ÆĪļµÄµē×ÓŹ½ £¬Š“³öYµÄ¼ņµ„Ēā»ÆĪļµÄµē×ÓŹ½ ”£
£Ø3£©YµÄ×īøß¼ŪŃõ»ÆĪļ¶ŌÓ¦µÄĖ®»ÆĪļµÄÅØČÜŅŗ¾ĆÖĆŗó³ŹĻÖ»ĘÉ«£¬Š“³ö·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½ ”£
£Ø4£©ŹµŃéŹŅÖĘČ”YµÄĒā»ÆĪļµÄ·½³ĢŹ½ £¬øĆ·“Ó¦ £ØĢī”°ŹĒ”±»ņ”°²»ŹĒ”±£©Ńõ»Æ»¹Ō·“Ó¦”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŌNaClµČĪŖŌĮĻÖʱøKClO4µÄ¹ż³ĢČēĻĀ£ŗ
¢ŁŌŚĪŽøōĤ”¢Ī¢ĖįŠŌĢõ¼žĻĀ£¬·¢Éś·“Ó¦£ŗNaCl+H2O![]() NaClO3+H2”ü(Ī“ÅäĘ½)
NaClO3+H2”ü(Ī“ÅäĘ½)
¢ŚŌŚNaClO3ČÜŅŗÖŠ¼ÓČėKCl·¢Éśø“·Ö½ā·“Ó¦£¬½µĪĀ½į¾§£¬µĆKClO3”£
¢ŪŅ»¶ØĢõ¼žĻĀ·“Ó¦£ŗ4KClO3![]() 3KClO4+KCl£¬½«²śĪļ·ÖĄėµĆµ½KClO4”£
3KClO4+KCl£¬½«²śĪļ·ÖĄėµĆµ½KClO4”£
£Ø1£©µē½āŹ±£¬²śÉśÖŹĮæĪŖ2.13g NaClO3£¬Ķ¬Ź±µĆµ½H2µÄĢå»żĪŖ L(±ź×¼×“æö)”£
£Ø2£©ĻņNaClO3ČÜŅŗÖŠ¼ÓČėKClÄܵƵ½KClO3µÄŌŅņŹĒ ”£
£Ø3£©øĆ¹ż³ĢÖʵƵÄKClO4ѳʷ֊ŗ¬ÉŁĮæKClŌÓÖŹ£¬ĪŖ²ā¶Ø²śĘ·“æ¶Č½ųŠŠČēĻĀŹµŃé£ŗ
×¼Č·³ĘČ”5.689gѳʷČÜÓŚĖ®ÖŠ£¬Åä³É250mLČÜŅŗ£¬“ÓÖŠČ”³ö25.00mLӌ׶ŠĪĘæÖŠ£¬¼ÓČėŹŹĮæĘĻĢŃĢĒ£¬¼ÓČČŹ¹ClO4-Č«²æ×Ŗ»ÆĪŖCl-(·“Ó¦ĪŖ£ŗ3 KClO4+C6H12O6 ØT 6 H2O + 6 CO2”ü+ 3 KCl)£¬¼ÓČėÉŁĮæK2CrO4ČÜŅŗ×÷ÖøŹ¾¼Į£¬ÓĆ0.20mol/L AgNO3ČÜŅŗ½ųŠŠµĪ¶ØÖĮÖÕµć£¬ĻūŗÄAgNO3ČÜŅŗĢå»ż21.00mL”£µĪ¶Ø“ļµ½ÖÕµćŹ±£¬²śÉś×©ŗģÉ«Ag2CrO4³Įµķ”£
¢Ł ŅŃÖŖ£ŗ Ksp(AgCl)£½1.8”Į10£10£¬Ksp(Ag2CrO4)£½1.1”Į10£12£¬Čōc(CrO42£)£½1.1”Į10-4mol/L£¬Ōņ“ĖŹ±c(Cl£)£½ mol/L”£
¢Ś ¼ĘĖćKClO4ѳʷµÄ“æ¶Č(ĒėŠ“³ö¼ĘĖć¹ż³Ģ”£)
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æX”¢Y”¢Z”¢M”¢GĪåÖÖŌŖĖŲ·ÖŹōČżøö¶ĢÖÜĘŚ£¬ĒŅŌ×ÓŠņŹżŅĄ“ĪŌö“ó”£X”¢ZĶ¬Ö÷×壬æÉŠĪ³ÉĄė×Ó»ÆŗĻĪļZX£»Y”¢MĶ¬Ö÷×壬æÉŠĪ³ÉMY2”¢MY3Į½ÖÖ·Ö×Ó”£
Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©YŌŚŌŖĖŲÖÜĘŚ±ķÖŠµÄĪ»ÖĆĪŖ________________”£
£Ø2£©ÉĻŹöŌŖĖŲµÄ×īøß¼ŪŃõ»ÆĪļ¶ŌÓ¦µÄĖ®»ÆĪļĖįŠŌ×īĒæµÄŹĒ_______________£ØŠ“»ÆѧŹ½£©£¬·Ē½šŹōĘųĢ¬Ēā»ÆĪļ»¹ŌŠŌ×īĒæµÄŹĒ__________________£ØŠ“»ÆѧŹ½£©”£
£Ø3£©Y”¢GµÄµ„ÖŹ»ņĮ½ŌŖĖŲÖ®¼äŠĪ³ÉµÄ»ÆŗĻĪļæÉ×÷Ė®Ļū¶¾¼ĮµÄÓŠ___________£ØŠ“³öĘäÖŠĮ½ÖÖĪļÖŹµÄ»ÆѧŹ½£©”£
£Ø4£©Z2Y2ÖŠµÄ»Æѧ¼üĄąŠĶŹĒ_____________________£»Z2Y2ÓėĖ®·“Ó¦·Å³öĘųĢåµÄĄė×Ó·½³ĢŹ½ĪŖ
________ _____ӣ
£Ø5£© ČŪȌדĢ¬ĻĀ£¬ZµÄµ„ÖŹŗĶFeG2ÄÜ×é³Éæɳäµēµē³Ų£Ø×°ÖĆŹ¾ŅāĶ¼ČēĻĀ£©£¬·“Ó¦ŌĄķĪŖ£ŗ
2Z + FeG2![]() Fe + 2ZG ·ÅµēŹ±£¬µē³ŲµÄøŗ¼«²ÄĮĻĪŖ______£¬·¢Éś ·“Ó¦
Fe + 2ZG ·ÅµēŹ±£¬µē³ŲµÄøŗ¼«²ÄĮĻĪŖ______£¬·¢Éś ·“Ó¦
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
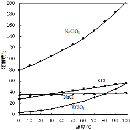
”¾ĢāÄæ”泬ŅōĖŁ·É»śŌŚĘ½Į÷²ć·ÉŠŠŹ±£¬Ī²ĘųÖŠµÄNO»įĘĘ»µ³ōŃõ²ć”£æĘѧ¼ŅÕżŌŚŃŠ¾æĄūÓĆ“ß»Æ¼¼Źõ½«Ī²ĘųÖŠµÄNOŗĶCO×Ŗ±ä³ÉCO2ŗĶN2£¬»Æѧ·½³ĢŹ½ČēĻĀ£ŗ2NO + 2CO![]() 2CO2 + N2”£ĪŖĮĖ²ā¶ØŌŚÄ³Ö֓߻ƼĮ×÷ÓĆĻĀµÄ·“Ó¦ĖŁĀŹ£¬ŌŚÄ³ĪĀ¶ČĻĀÓĆĘųĢå“«øŠĘ÷²āµĆ²»Ķ¬Ź±¼äµÄNOŗĶCOÅضČČē±ķ£ŗ
2CO2 + N2”£ĪŖĮĖ²ā¶ØŌŚÄ³Ö֓߻ƼĮ×÷ÓĆĻĀµÄ·“Ó¦ĖŁĀŹ£¬ŌŚÄ³ĪĀ¶ČĻĀÓĆĘųĢå“«øŠĘ÷²āµĆ²»Ķ¬Ź±¼äµÄNOŗĶCOÅضČČē±ķ£ŗ
Ź±¼ä/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/mol”¤L-1 | 1.00”Į10-3 | 4.50”Į10-4 | 2.50”Į10-4 | 1.50”Į10-4 | 1.00”Į10-4 | 1.00”Į10-4 |
c(CO)/mol”¤L-1 | 3.60”Į10-3 | 3.05”Į10-3 | 2.85”Į10-3 | 2.75”Į10-3 | 2.70”Į10-3 | 2.70”Į10-3 |
Ēė»Ų“šĻĀĮŠĪŹĢā(¾ł²»æ¼ĀĒĪĀ¶Č±ä»Æ¶Ō“߻ƼĮ“߻Ɗ§ĀŹµÄÓ°Ļģ):
£Ø1£© Ē°3sµÄĘ½¾ł·“Ó¦ĖŁĀŹv(N2)£½_____________”£(“š°ø±£Įō2Ī»Š”Źż)
£Ø2£© ¼ĘĖć4sŹ±COµÄ×Ŗ»ÆĀŹ¦Į £½ ”£
£Ø3£© ĻĀĮŠ“ėŹ©ÄÜĢįøßNOŗĶCO×Ŗ±ä³ÉCO2ŗĶN2µÄ·“Ó¦ĖŁĀŹµÄŹĒ( )
A.Ń”ÓĆøüÓŠŠ§µÄ“߻ƼĮ B.Éżøß·“Ó¦ĢåĻµµÄĪĀ¶Č
C£®½µµĶ·“Ó¦ĢåĻµµÄĪĀ¶Č D.ĖõŠ”ČŻĘ÷µÄĢå»ż
£Ø4£© ŃŠ¾æ±ķĆ÷£ŗŌŚŹ¹ÓƵČÖŹĮæ“߻ƼĮŹ±£¬Ōö“ó“߻ƼĮ±Č±ķĆ껿æÉĢįøß»Æѧ·“Ó¦ĖŁĀŹ”£ĪŖĮĖ·Ö±šŃéÖ¤ĪĀ¶Č”¢“߻ƼĮ±Č±ķĆ껿¶Ō»Æѧ·“Ó¦ĖŁĀŹµÄÓ°Ļģ¹ęĀÉ£¬Ä³Ķ¬Ń§Éč¼ĘĮĖČż×鏵Ń飬²æ·ÖŹµŃéĢõ¼žŅŃ¾ĢīŌŚĻĀĆꏵŃéÉč¼Ę±ķÖŠ”£
ŹµŃ鱹ŗÅ | T/”ę | NO³õŹ¼ÅضČ/mol”¤L-1 | CO³õŹ¼ÅضČ/ mol”¤L-1 | “߻ƼĮµÄ±Č±ķĆ껿/m2”¤g-1 |
¢ń | 280 | 1.20”Į10-3 | 5.80”Į10-3 | 82 |
¢ņ | 124 | |||
¢ó | 350 | 124 |
¢ŁĒėŌŚÉĻ±ķøńÖŠĢīČėŹ£ÓąµÄŹµŃéĢõ¼žŹż¾Ż”£
¢ŚĒėŌŚøų³öµÄ×ų±źĶ¼ÖŠ£¬»³öÉĻ±ķÖŠµÄ¢ń”¢¢ņĮ½øöŹµŃéĢõ¼žĻĀ»ģŗĻĘųĢåÖŠNOÅضČĖꏱ¼ä±ä»ÆµÄĒ÷ŹĘĒśĻßĶ¼£¬²¢±źĆ÷ø÷ĢõĒśĻߏĒŹµŃ鱹ŗÅ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÕą¼°Ęä»ÆŗĻĪļ±»¹ć·ŗÓ¦ÓĆÓŚ°ėµ¼Ģ唢“߻ƼĮµČĮģÓņ”£ŅŌĒ¦Šææóŗ¬ÕąŃĢ³¾ĪŖŌĮĻæÉÖʱøGeO2£¬Ę乤ŅÕĮ÷³ĢĶ¼ČēĻĀ”£

ŅŃÖŖ£ŗGeO2ŹĒĮ½ŠŌŃõ»ÆĪļ£»GeCl4Ņ×Ė®½ā£¬·Šµć86.6”ę
£Ø1£©µŚ¢Ł²½ĀĖŌüÖ÷ŅŖ³É·ÖÓŠ_____________£ØĢī»ÆѧŹ½£©£¬ŹµŃéŹŅŻĶČ”²Ł×÷ÓƵ½µÄ²£Į§ŅĒĘ÷ÓŠ__________________”£
£Ø2£©µŚ¢Ū²½ŻĶČ”Ź±£¬ÕąµÄŻĶČ”ĀŹÓėVĖ®Ļą/VÓŠ»śĻą£ØĖ®ĻąŗĶÓŠ»śĻąµÄĢå »ż±Č£©µÄ¹ŲĻµČēĻĀĶ¼ĖłŹ¾£¬“ÓÉś²ś³É±¾½Ē¶Čæ¼ĀĒ£¬½ĻŹŹŅĖµÄVĖ®Ļą/VÓŠ»śĻąµÄÖµĪŖ ”£

£Ø3£©µŚ¢Ü²½¼ÓČėŃĪĖįµÄ×÷ÓĆ__________________________________£Ø“šĮ½µć¼“æÉ£©£¬Ó¦æŲÖĘĪĀ¶ČµÄ·½·Ø¼°·¶Ī§____________________________”£
£Ø4£©µŚ¢Ż²½·“Ó¦µÄ»Æѧ·½³ĢŹ½_______________________________”£
£Ø5£©¶žŃõ»ÆÕąæÉĻČÓĆ“ĪŃĒĮ×ĖįÄĘ»¹ŌĪŖGe2+£¬ÓƵķ·ŪČÜŅŗ×÷ÖøŹ¾¼Į£¬ÓĆc mol/LµāĖį¼Ų±ź×¼ČÜŅŗµĪ¶Ø£¬ĻūŗÄĢå»żVmL,ĮŠ³öŃĢ³¾ÖŠÕąµÄÖŹĮæ·ÖŹżµÄ¼ĘĖćŹ½________”££ØÓŠ¹Ų·“Ó¦Ź½ĪŖ£ŗ3Ge2++IO3-+6H+£½3Ge4++I-+3H2O£¬IO3-+5I-+6H+£½3I2+3H2O£©”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖ£ŗ¢Ł2H2(g)+O2(g)=2H2O(l);”÷H=£572kJ/mol
¢Ś2H2(g)+O2(g)=2H2O(g);”÷H=£484kJ/mol
¢ŪCH4(g)+2O2(g)=2H2O(l)+CO2(g);”÷H=£890kJ/mol
£Ø1£©ŅŃÖŖH-HµÄ¼üÄÜ436kJ/molO=OµÄ¼üÄÜ496kJ/molH-OµÄ¼üÄÜ463kJ/mol£¬øł¾ŻÉĻŹöŹż¾Ż¼ĘĖć¢Ł¢ŚÄÄŅ»øö·“Ó¦æÉŅŌĶعż¼üÄÜÖ±½Ó¼ĘĖćµĆ³ö ”£²¢¼ĘĖ抓³ö·“Ó¦ H2O ( l ) = H2O ( g )µÄģŹ±ä”÷H= ”£
£Ø2£©Ēėøł¾ŻĢāøɼĘĖćCO2£Øg£©+4H2( g ) =CH4( g ) +2H2O( g )µÄģŹ±ä”÷H= ”£
£Ø3£©ŌŚ¢Ł¢Ś¢ŪČżøö·½³ĢŹ½ÖŠÄÄŅ»øöŹĒČ¼ÉÕČȵÄČČ»Æѧ·½³ĢŹ½ ”££ØĢī·“Ó¦·½³ĢŹ½µÄŠņŗÅ£©±ź×¼×“æöĻĀ£¬Č”¼×ĶéŗĶĒāĘųµÄ»ģŗĻĘųĢå11.2 LĶźČ«Č¼ÉÕŗó»Öø“µ½³£ĪĀ£¬Ōņ·Å³öµÄČČĮæĪŖ263.8kJ£¬ŹŌĒó»ģŗĻĘųĢåÖŠ¼×ĶéŗĶĒāĘųĢå»ż±Č ”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com