
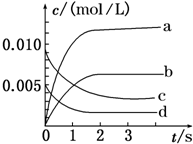
 在2L密闭容器内,800℃时X(g)和Y(g)反应生成Z(g)的体系中,n(X)随时间的变化如表所示:(已知:2X(g)+Y(g)?2Z(g) )
在2L密闭容器内,800℃时X(g)和Y(g)反应生成Z(g)的体系中,n(X)随时间的变化如表所示:(已知:2X(g)+Y(g)?2Z(g) )| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(X)/mol | 0.020 | 0.010 | 0.008 | 0.008 | 0.008 | 0.008 |
分析 (1)由表中数据可知从2s开始,X的物质的量为0.008mol,不再变化,2s时反应达平衡,4s时消耗的X为0.02mol-0.008mol=0.012mol,进而计算X转化率;
(2)Z是产物,随反应进行浓度增大,平衡时△c(Z)=△c(X);
根据v=$\frac{△c}{△t}$计算v(X),再利用速率之比等于化学计量数之比计算v(Y)
解答 解:(1)由表中数据可知从2s开始,X的物质的量为0.008mol,不再变化,2s时反应达平衡,4s时消耗的X为0.02mol-0.008mol=0.012mol,X转化率为$\frac{0.012mol}{0.02mol}$×100%=60%,
答:在第4s时,X的转化率为60%;
(2)Z是产物,随反应进行浓度增大,平衡时△c(Z)=△c(X)=$\frac{0.02mol-0.008mol}{2L}$=0.006mol/L,所以图中表示Z变化的曲线是b;
2s内用X表示的平均反应速率v(X)=$\frac{\frac{0.02mol-0.008mol}{2L}}{2s}$=3.0×10-3mol•L-1•s-1,速率之比等于化学计量数之比,所以v(Y)=$\frac{1}{2}$v(X)=$\frac{1}{2}$×3.0×10-3mol•L-1•s-1=1.5×10-3mol•L-1•s-1,
故答案为:b;1.5×10-3mol•L-1•s-1.
点评 本题考查化学平衡计算、反应速率计算等,比较基础,旨在考查学生对基础知识的解掌握.


 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:填空题
 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液中:Fe2+、NO3-、SO42-、Na+ | |
| B. | c(S2-)=0.1 mol•L-1的溶液中:K+、Cu2+、SO42-、Cl- | |
| C. | c(H+)/c(OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl- | |
| D. | 水电离的c(H+)=1×10-14mol•L-1的溶液中:Ca2+、K+、Cl-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定含有SO42- | B. | 一定同时含有Ag+和SO42- | ||
| C. | 一定含有Ag+ | D. | Ag+或SO42-至少含有一种 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | IBr的化学性质不如氯气活泼 | |
| B. | 在很多反应中IBr充当氧化剂 | |
| C. | IBr跟水反应时既是氧化剂又是还原剂 | |
| D. | 跟NaOH溶液反应生成NaBr和NaIO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮化钛(Ti3N4)为金黄色晶体,由于具有令人满意的仿金效果,越来越多地成为黄金的代替品.以TiCl4为原料,经过一系列反应(如图1所示)可以制得Ti3N4和TiO2.
氮化钛(Ti3N4)为金黄色晶体,由于具有令人满意的仿金效果,越来越多地成为黄金的代替品.以TiCl4为原料,经过一系列反应(如图1所示)可以制得Ti3N4和TiO2.| I1 | I2 | I3 | I4 | I5 | |
| 电离能/KJ•mol-1 | 738 | 1451 | 7733 | 10540 | 13630 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沉淀A只有Cr(OH)3 | |
| B. | 第①步平衡体系中,加入适量稀硫酸后,溶液颜色变黄色,则有利于CrO42-的生成 | |
| C. | 第②步中,还原0.1mol Cr2O72-需要45.6gFeSO4 | |
| D. | 第③步沉淀剂a可以使用NaOH等碱性物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com