
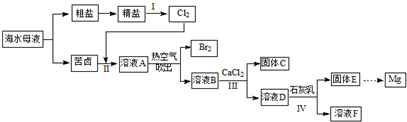
分析 母液中主要含有Cl-、Na+、K+、Ca2+、SO42-、Br-等离子,通过蒸发浓缩析出氯化钠得到粗盐和母液苦卤,粗盐加入试剂除杂精制得到精盐,电解饱和食盐水或电解熔融氯化钠应用于烧碱工业和钠的制备,反应过程中都有氯气生成,把氯气通入苦卤氧化其中的溴离子为溴单质,溴单质易挥发,溶液A通过热空气吹出溴单质,得到溶液B主要为镁离子、SO42-等离子,加入氯化钙溶液目的是沉淀硫酸根离子,过滤得到溶液D中加入石灰乳沉淀镁离子,过滤得到氢氧化镁沉淀,通过加入盐酸溶解,浓缩蒸发,冷却结晶,过滤洗涤,得到氯化镁晶体,失水后得到固体氯化镁,电解熔融氯化镁得到金属镁,
(1)海水淡化水,应将水与盐分离,可用蒸馏、电渗析或离子交换法等;
(2)电解饱和食盐水生成氢氧化钠、氯气和氢气,据此写出反应的离子方程式;
(3)Cl、Br原子最外层都含有7个电子,两个原子各提供一个电子形成共用电子对,使最外层均得到8电子稳定结构;
(4)溶液B中含有硫酸根离子,加入氯化钙溶液可以反应生成硫酸钙,从而除去硫酸根离子;
(5)氢氧化镁比氢氧化钙更难溶,则IV中镁离子与氢氧化钙反应生成氢氧化镁沉淀和钙离子.
解答 解:(1)目前淡化海水的方法有多种,如:蒸馏法、电渗析法、离子交换法等,其中最常用的是蒸馏法,
故答案为:蒸馏法(或电渗析法、离子交换法);
(2)电解饱和食盐水生成氢氧化钠、氯气和氢气,反应的离子方程式为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+Cl2↑+H2↑,
故答案为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+Cl2↑+H2↑;
(3)由于氯、溴元素位于同一主族,最外层均为7e-,两个原子各提供1e-,形成共用电子对,两个原子都形成了8e-稳定结构,所以氯气和溴单质都是以双原子形式存在,
故答案为:氯、溴元素位于同一主族,最外层均为7e-,两个原子各提供1e-,形成共用电子对,两个原子都形成了8e-稳定结构;
(4)硫酸根离子能够与钙离子反应生成硫酸钙沉淀,所以加入氯化钙溶液的目的是除去SO42-,故答案为:除去SO42-;
(5)氢氧化镁更难溶,IV中镁离子与氢氧化钙反应生成氢氧化镁沉淀和钙离子,该反应的离子方程式为:Mg2++Ca(OH)2═Mg(OH)2+Ca2+,
故答案为:Mg2++Ca(OH)2═Mg(OH)2+Ca2+.
点评 本题考查物质的分离、提纯以及制备实验,为高考常见题型和高频考点,题目难度中等,试题知识点较多、充分考查学生的分析、理解能力及灵活应用基础知识的能力,注意掌握海水资源的综合应用方法.


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.1 g | B. | 10.2 g | C. | 13.6 g | D. | 15.3 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
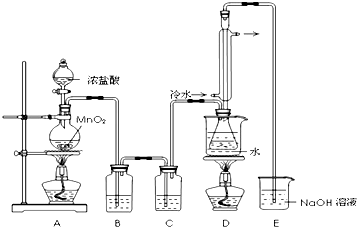
| 物质 | 沸点/℃ | 熔点/℃ |
| S | 445 | 113 |
| CS2 | 47 | -109 |
| CCl4 | 77 | -23 |
| S2Cl2 | 137 | -77 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
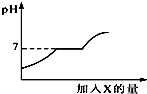 现有盐酸和CaCl2的混合溶液,向其中逐滴加入过量某物质X,溶液的pH随滴入X的量的变化关系如图所示.则X是( )
现有盐酸和CaCl2的混合溶液,向其中逐滴加入过量某物质X,溶液的pH随滴入X的量的变化关系如图所示.则X是( )| A. | 水 | B. | 澄清石灰水 | C. | 纯碱溶液 | D. | 稀盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com