
(14分)㈠下列物质属于非电解质的是 ,属于弱电解质的是
①氨水 ②SO2 ③CI2 ④甲酸 ⑤BaSO4 ⑥CH3OH ⑦H2O ⑧NaHCO3 ⑨AI2O3
㈡有A、B、C、D、E和F六瓶无色溶液,他们都是中学化学中常用的无机试剂。纯E为无色油状液体;B、C、D和F是盐溶液,且他们的阴离子均不同。现进行如下实验:
①A有刺激性气味,用沾有浓盐酸的玻璃棒接近A时产生白色烟雾;
②将A分别加入其它五种溶液中,只有D、F中有沉淀产生;继续加入过量A时,D中沉淀无变化,F中沉淀完全溶解;
③将B分别加入C、D、E、F中,C、D、F中产生沉淀,E中有无色、无味气体逸出;
④将C分别加入D、E、F中,均有沉淀生成,再加入稀HNO3,沉淀均不溶。
根据上述实验信息,请回答下列问题:
(1)能确定的溶液是(写出溶液标号与相应溶质的化学式):
(2)不能确定的溶液,写出其标号、溶质可能的化学式及进一步鉴别的方法:
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:058
现有下列物质:①NaCl晶体,②液态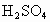 ,③NaCl溶液,④Cu,⑤
,③NaCl溶液,④Cu,⑤ 固体,⑥纯蔗糖,⑦酒精,⑧熔融
固体,⑥纯蔗糖,⑦酒精,⑧熔融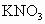 ,⑨
,⑨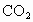 气体,⑩
气体,⑩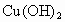 固体.
固体.
(1)在题目指定的状态下,以上物质能导电的是____________.
(2)上述物质中属于强电解质的是________________.
(3)上述物质中属于非电解的质是_______________.
查看答案和解析>>
科目:高中化学 来源: 题型:022
现有下列物质:①NaCl晶体,②液态 ,③NaCl溶液,④Cu,⑤
,③NaCl溶液,④Cu,⑤ 固体,⑥纯蔗糖,⑦酒精,⑧熔融
固体,⑥纯蔗糖,⑦酒精,⑧熔融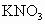 ,⑨
,⑨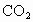 气体,⑩
气体,⑩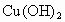 固体.
固体.
(1)在题目指定的状态下,以上物质能导电的是____________.
(2)上述物质中属于强电解质的是________________.
(3)上述物质中属于非电解的质是_______________.
查看答案和解析>>
科目:高中化学 来源:2010-2011学年山东省莱芜市高一(下)期末化学试卷(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com