

分析 (1)实验室用加热固体氯化铵与氢氧化钙方法制取氨气;
(2)依据氨气为碱性气体,应选择碱性干燥剂解答;
(3)图(1)中棉花的作用是:防止生成的氨气与空气发生对流,使收集到的氨气不纯;氨气与浓盐酸反应生成氯化铵固体,有白烟生成,氨气水溶液呈碱性,可使石蕊试纸变蓝色,据此检验氨气是否收集满;
(4)喷泉实验需形成明显的压力差;
氨气溶于水,溶液体积等于氨气体积,令氨气的体积为22.4L,则溶液的体积为22.4L,根据n=$\frac{n}{Vm}$计算氨气的物质的量,再根据c=$\frac{n}{V}$计算溶液的物质的量浓度.
解答 解:(1)加热固体氯化铵与氢氧化钙生成氨气、水氯化钙,方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+CaCl2+2H2O;
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+CaCl2+2H2O;
(2)氨气为碱性气体,应选择碱性干燥剂,碱石灰为碱性干燥剂,可以干燥氨气;
故答案为:碱石灰;
(3)图(1)中棉花的作用是:防止生成的氨气与空气发生对流,使收集到的氨气不纯;
氨气与浓盐酸反应生成氯化铵固体,有白烟生成,所以可以用蘸取浓盐酸的玻璃棒靠近管口,若有白烟表示集满了;氨气水溶液呈碱性,可用湿润的红色石蕊试纸检验,若红色石蕊试纸变蓝说明收集满了;
故答案为:防止生成的氨气与空气发生对流,使收集到的氨气不纯;
用蘸取浓盐酸的玻璃棒靠近管口,若有白烟表示集满了(或用湿润的红色石蕊试纸靠近管口,若变蓝表示收集满了);
(4)氨气是一种极易溶于水的气体,将胶头滴管中的水挤入烧瓶中,瓶内压强减小,在外界气压的作用下,水被压到瓶内,形成喷泉现象;
氨气溶于水,溶液体积等于氨气体积,令氨气的体积为22.4L,则溶液的体积为22.4L,标况下22.4L氨气的物质的量=$\frac{22.4L}{22.4L/mol}$=1mol,故所得溶液的物质的量浓度=$\frac{1mol}{22.4L}$=0.045mol/L,
故答案为:挤出胶头滴管中的水进入烧瓶,打开止水夹;0.045mol/L;
点评 本题考查了氨气的制备和性质,物质的量浓度的计算,解答时需理解相关的原理,注意形成喷泉的原理和操作方法是解答的关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 在相同状况下,同体积的乙醇气体和乙烯气体究全燃烧,耗氧量不相同 | |
| B. | 在相同状况下,同体积的乙醇气体和乙烯气体完全燃烧,放出的热量相同 | |
| C. | 用乙醇作燃料不会导致“温窒效应” | |
| D. | 用乙醇作燃料不会导致酸雨 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 N,P,As等元素的化合物在生产和研究中有许多重要用途.请回答下列问题:
N,P,As等元素的化合物在生产和研究中有许多重要用途.请回答下列问题: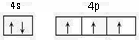 ,砷与同周期相邻元素的第一电离能由大到小的顺序为As>Se>Ge.
,砷与同周期相邻元素的第一电离能由大到小的顺序为As>Se>Ge.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 在0-50min之间,pH=2 和 pH=7 时 R 的降解百分率相等 | |
| B. | 溶液酸性越强,R 的降解速率越小 | |
| C. | R的起始浓度越小,降解速率越大 | |
| D. | 在 20-25min之间,pH=10 时 R 的平均降解速率为 0.04mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
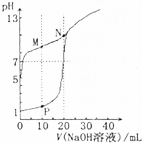
| A. | HX是弱酸,其c(OH-)是该盐酸中c(OH-)的104倍 | |
| B. | N点的pH>7的原因是由于NaOH过量所致 | |
| C. | M点c(HX)<c(X-) | |
| D. | P点c(Cl-)=0.05mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,pH=7的NH4Cl与氨水的混合溶液中离子浓度大小顺序为c(Cl-)>c(NH+4)>c(H+)>c(OH-) | |
| B. | 将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 | |
| C. | 常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大 | |
| D. | 将pH=4的醋酸溶液和pH=10的氢氧化钠溶液等体积混合,所得溶液的pH一定大于7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. (或
(或 )(写出任一种的结构简式).
)(写出任一种的结构简式). .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com