
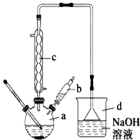
 溴苯是一种常用的化工原料.实验室制备溴苯的实验步骤如下:
溴苯是一种常用的化工原料.实验室制备溴苯的实验步骤如下:| 苯 | 溴 | 溴苯 | |
| 密度/gcm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 在水中的溶解度 | 微溶 | 微溶 | 微溶 |
 ;
;分析 (1)步骤1仪器a中,苯与液溴发生取代反应制备溴苯;
(2)由图可知仪器c的名称,仪器d为倒扣的漏斗,吸收气体时可防止液体倒吸;
(3)将b中的液溴慢慢加入到a中,防止溴挥发;
(4)仪器c的作用是冷凝回流,使反应物尽可能充分反应;
(5)步骤4得到的粗产品中还含有杂质苯,由苯、溴苯的有关物理性质可知,则要进一步提纯粗产品,利用互溶液体的沸点不同分离;
(6)实验结束后,设计实验方案检验d装置所得溶液中含有Br-,需要硝酸、硝酸银,生成淡黄色沉淀即可.
解答 解:(1)步骤1仪器a中,苯与液溴发生取代反应制备溴苯,反应为 ,
,
故答案为: ;
;
(2)由图可知仪器c的名称为冷凝管,仪器d的作用为吸收HBr防污染,防倒吸,
故答案为:冷凝管;吸收HBr防污染,防倒吸;
(3)将b中的液溴慢慢加入到a中,而不能快速加入的原因是防止反应放出的热使C6H6、Br2挥发而影响产率,
故答案为:防止反应放出的热使C6H6、Br2挥发而影响产率;
(4)仪器c的作用是冷凝回流,使反应物尽可能充分反应,则回流的主要物质有C6H6、Br2,
故答案为:C6H6、Br2;
(5)步骤4得到的粗产品中还含有杂质苯,由苯、溴苯的有关物理性质可知,则要进一步提纯粗产品,利用互溶液体的沸点不同分离,则还进行的实验操作名称是蒸馏,
故答案为:蒸馏;
(6)实验结束后,设计实验方案检验d装置所得溶液中含有Br-,实验操作为取少量d中溶液于试管中,滴加过量稀HNO3,再加入AgNO3溶液,现象和结论为有淡黄色沉淀生成,溶液中含有Br-,
故答案为:取少量d中溶液于试管中,滴加过量稀HNO3,再加入AgNO3溶液;有淡黄色沉淀生成,溶液中含有Br-.
点评 本题考查有机物的制备实验,为高频考点,把握制备实验原理、实验技能、混合物分离提纯、离子检验等为解答的关键,侧重分析与实验能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 碱式滴定管只用水洗,而未用待测液润洗 | |
| B. | 锥形瓶中残留有蒸馏水 | |
| C. | 酸式滴定管滴定前尖嘴处有气泡,滴定后气泡消失 | |
| D. | 滴定前仰视刻度读数,滴定后俯视刻度读数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用标准FeCl3溶液滴定KI溶液,选择KSCN溶液 | |
| B. | 用I2溶液滴定Na2SO3溶液,淀粉作指示剂 | |
| C. | 用AgNO3溶液滴定NaCl溶液,Na2CrO4作指示剂 | |
| D. | 用H2O2溶液滴定KI溶液,淀粉作指示剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
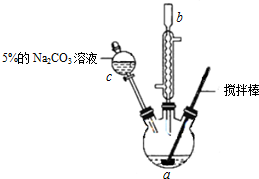
| 密度 | 沸点 | 溶解性 | ||
| 丙烯酸 | 1.05g/cm3 | 141℃ | 与水互溶,易溶于有机溶剂 | 有毒 |
| 甲醇 | 0.79g/cm3 | 64.7℃ | 与水互溶,易溶于有机溶剂 | 易挥发,有毒 |
| 丙烯酸甲酯 | 0.95g/cm3 | 80.5℃ | 难溶于水,易溶于有机溶剂 | 易挥发 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
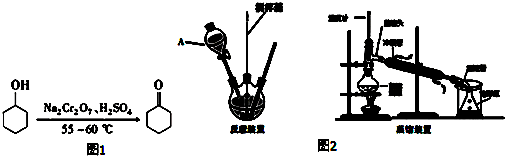
| 名称 | 性状 | 密度 | 溶点℃ | 沸点℃ | 溶解度 | |
| 水 | 乙醚 | |||||
| 环已醇 | 无色,有刺激性气味 | 0.9624 | 25.93 | 161.5 | 5.67g/100mL | ∞ |
| 环已酮 | 无色,有刺激性气味 | 0.9478 | - | 155.7 | 2.4g/100mL | ∞ |
 +1 Na2Cr2O7+4H2SO4→3
+1 Na2Cr2O7+4H2SO4→3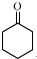 +1 Na2SO4+1 Cr2(SO4)3+7 H2O
+1 Na2SO4+1 Cr2(SO4)3+7 H2O查看答案和解析>>
科目:高中化学 来源: 题型:解答题
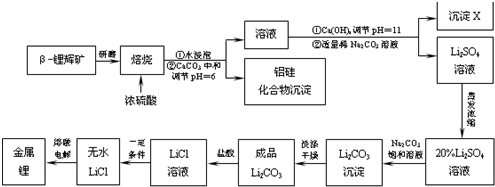
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
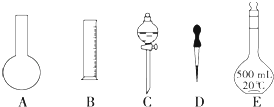
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 汽油失火时,立即用水灭火 | |
| B. | 实验室不小心碰翻酒精灯引起实验桌上洒落的少量酒精起火时,迅速用泡沫灭火器灭火 | |
| C. | 浓硫酸溅到皮肤上,立即用稀 NaOH 溶液洗涤 | |
| D. | 浓 NaOH 溶液溅到皮肤上,立即用水冲洗,然后涂上稀硼酸溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com