
| A. | 向氯化铝溶液中加入过量氨水:A13++4NH3•H2O═AlO2-+2H2O+4NH4+ | |
| B. | 氧化铁溶于氢碘酸溶液中:Fe2O3+6H++2I-═2Fe2++I2+3H2O | |
| C. | 光导纤维在碱性环境中易断裂:Si+2OH-+H2O═SiO32-+2H2↑ | |
| D. | 澄清石灰水中加入过量小苏打溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O |
分析 A.氨水为弱碱,二者反应生成氢氧化铝沉淀;
B.二者发生氧化还原反应生成亚铁离子和碘单质;
C.光导纤维的主要成分为二氧化硅,不是单质硅;
D.小苏打为碳酸氢钠,碳酸氢钠过量,离子方程式按照氢氧化钙的化学式书写.
解答 解:A.氯化铝与氨水反应生成氢氧化铝沉淀和氯化铵,正确的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故A错误;
B.氧化铁溶于氢碘酸溶液中,碘离子被铁离子氧化成碘单质,反应的离子方程式为:Fe2O3+6H++2I-═2Fe2++I2+3H2O,故B正确;
C.光导纤维在碱性环境中易断裂,原因是二氧化硅与氢氧根离子反应,正确的离子方程式为:SiO2+2OH-═SiO32-+2H2O,故C错误;
D.澄清石灰水中加入过量小苏打溶液,反应生成碳酸钙沉淀、碳酸钠和水,正确的离子方程式为:Ca2++2HCO3-+2OH-═HCO32-+CaCO3↓+2H2O,故D错误;
故选B.
点评 本题考查了离子方程式的判断,题目难度不大,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 热还原法 | B. | 分解法 | C. | 电解法 | D. | 富集法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6:1 | B. | 5:1 | C. | 3:1 | D. | 2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
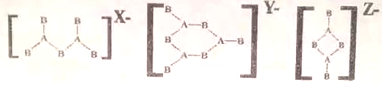
| A. | 4、4、2 | B. | 4、3、2 | C. | 3、3、2 | D. | 4、2、2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 不溶物一定是铜 | |
| B. | 不溶物一定是铁 | |
| C. | 不溶物中一定含铜,但不一定含铁 | |
| D. | 滤液中一定含有FeSO4,一定没有CuSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 一定条件下,体积为10L的密闭容器中,1molX和1mol Y进行反应:2X(g)+2Y(g)?Z(g),经60s达到平衡,生成0.3molZ.下列说法正确的是( )
一定条件下,体积为10L的密闭容器中,1molX和1mol Y进行反应:2X(g)+2Y(g)?Z(g),经60s达到平衡,生成0.3molZ.下列说法正确的是( )| A. | 若升高温度,X的体积分数增大,则正反应的△H>0 | |
| B. | 将容器体积变为20L,Z的平衡浓度变为原来的$\frac{1}{2}$ | |
| C. | 以X浓度变化表示的反应速率为0.001mol/(L•s) | |
| D. | 若图纵坐标是正反应速率,则反应应该在绝热条件下进行,图象最高点为平衡点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用同一个滴管取用不同的药品 | |
| B. | 将实验中剩余的药品放回原试剂瓶 | |
| C. | 实验前对实验装置进行气密性检查 | |
| D. | 将实验室制备的可燃性气体直接点燃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 49 个 | B. | 50个 | C. | 51个 | D. | 无法确定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com