
分析 (1)单位物质的量的物质的质量为摩尔质量,摩尔质量是以g/mol为单位,数值上等于其相对分子质量或相对原子质量,12.4g(Na2R)中含Na+0.4mol,n(Na2R)=0.2mol,结合M=$\frac{m}{n}$计算;
(2)相同状况下的两种气体12C18O和14N2,计算其摩尔质量M(12C18O)=30g/mol,M(14N2)=28g/mol,两种气体的质量相等,依据n=$\frac{m}{M}$计算得到物质的量,其分子中含有的质子数12C18O为6+8=14,14N2为7×2=14,微粒个数之比即为物质的量之比,据此计算所含质子数之比,阿伏伽德罗定律是同温、同压、同体积的气体,气体物质的量相同,所含分子数相同.
解答 解:(1)12.4g(Na2R)中含Na+0.4mol,n(Na2R)=0.2mol,M=$\frac{m}{n}$=$\frac{12.4g}{0.2mol}$=62g/mol,则Na2R的摩尔质量为62g/mol,
故答案为:62g/mol;
(2)相同状况下的两种气体12C18O和14N2,计算其摩尔质量M(12C18O)=30g/mol,M(14N2)=28g/mol,两种气体的质量相等,设质量为1g,依据n=$\frac{m}{M}$计算得到物质的量,n(12C18O)=$\frac{1g}{30g/mol}$=$\frac{1}{30}$mol,n(14N2)=$\frac{1g}{28g/mol}$=$\frac{1}{28}$mol,其分子中含有的质子数12C18O为6+8=14,14N2为7×2=14,微粒个数之比即为物质的量之比,据此计算所含质子数之比=$\frac{1}{30}$×14:$\frac{1}{28}$×14=14:15,依据阿伏伽德罗定律内容可知,同温、同压、同体积的气体,气体物质的量相同,所含分子数相同,若两种气体的分子数相同,则体积相同,所以12C18O和14N2的体积之比为1:1,
故答案为:14:15,1:1.
点评 本题考查物质的量的计算,为高频考点,把握物质的量为中心的基本计算为解答的关键,侧重分析与计算能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 锥形瓶 | B. | 试管 | C. | 分液漏斗 | D. | 250mL容量瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A. | 向硫酸铜溶液中通入CO2 | 有蓝色沉淀生成 | 因发生双水解反应生成CuCO3沉淀 |
| B. | 向氯水中滴加少量石蕊试液 | 溶液先变红后褪色 | 氯水具有酸性和漂白性 |
| C. | 讲铜粉放入稀硫酸溶液中并不断通入O2,再在溶液中滴加少量FeSO4溶液 | 铜粉快速溶解,溶液变为蓝色 | 形成Fe-Cu原电池反应,加快反应速率 |
| D. | 向稀硝酸中加入过量Fe粉,反应完全再在溶液中滴加KSCN溶液 | 溶液变为血红色 | Fe与硝酸反应得到Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若向该溶液中加入过量的稀硫酸和KSCN溶液,溶液显血红色 | |
| B. | 若向该溶液中加入过量的稀硫酸,产生的气体遇空气能变成红棕色 | |
| C. | 该溶液中所含的离子是:Fe2+、Na+、SO42-、NO3- | |
| D. | 若向该溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体的质量为72g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCl2、NaOH、HCl、HD四种物质都属于化合物 | |
| B. | 硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物 | |
| C. | 溶液,浊液,胶体都属于混合物 | |
| D. | CO2、CO等非金属氧化物均属于酸性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
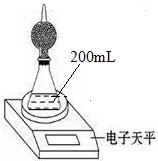 如图是测定铝粉(含铜粉等杂质不与酸反应)的纯度的实验装置.装置为干燥管和锥形瓶,干燥管内装有氯化钙,锥形瓶内所用的硫酸(足量)的物质的量浓度为4mol•L-1.不同时间电子天平的读数如下表所示:
如图是测定铝粉(含铜粉等杂质不与酸反应)的纯度的实验装置.装置为干燥管和锥形瓶,干燥管内装有氯化钙,锥形瓶内所用的硫酸(足量)的物质的量浓度为4mol•L-1.不同时间电子天平的读数如下表所示:| 实验操作 | t/min | 电子天平的读数/g |
| 装置+硫酸溶液 | 320.0 | |
| 装置+硫酸溶液+样品 | 0 | 335.0 |
| 1 | 334.5 | |
| 2 | 334.1 | |
| 3 | 333.8 | |
| 4 | 333.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 羟基的电子式: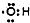 | |
| B. | 苯的分子式: | |
| C. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O | |
| D. | 甲烷分子的比例模型: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com