
| A. | 少量的CO2通入NaClO溶液中发生反应:NaClO+CO2+H2O=NaHCO3+HClO,说明酸性强弱的顺序为H2CO3>HClO>HCO3- | |
| B. | 金刚石是自然界中硬度最大的物质,不可能与氧气发生反应 | |
| C. | 浓H2SO4具有强氧化性,常温下就能与金属Cu发生剧烈反应 | |
| D. | NO2与H2O 反应的过程中,被氧化的氮原子与被还原的氮原子的个数比为1:2 |
分析 A.依据强酸制备弱酸解答;
B.金刚石为碳单质,能够与氧气反应;
C.依据铜与浓硫酸反应条件解答;
D.二氧化氮与水反应,二氧化氮既是氧化剂又是还原剂结合方程式 3NO2+H2O=2HNO3+NO↑判断.
解答 解:A.少量的CO2通入NaClO溶液中发生反应:NaClO+CO2+H2O=NaHCO3+HClO,依据强酸制备弱酸说明酸性强弱的顺序为H2CO3>HClO>HCO3-,故A正确;
B.金刚石为碳单质,能够与氧气反应生成二氧化碳,故B 错误;
C.铜与浓硫酸反应需要加热,故C错误;
D.依据方程式3NO2+H2O=2HNO3+NO↑,被氧化的氮原子与被还原的氮原子的个数比为2:1,故D错误;
故选:A.
点评 本题考查了元素化合物知识,熟悉相关物质的性质是解题关键,注意强酸制备弱酸的规律,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| 化学键 | C-H | C-F | H-F | F-F |
| 键能/(kJ•mol-1) | 414 | 489 | 565 | 155 |
| A. | +1940 kJ•mol-1 | B. | -1940 kJ•mol-1 | C. | -485 kJ•mol-1 | D. | +485 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ•mol-1,则H2燃烧热为241.8 kJ•mol-1 | |
| B. | 从C(石墨,s)═C(金刚石,s)△H=+1.9 kJ/mol,可知:金刚石比石墨更稳定 | |
| C. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量更多 | |
| D. | 化学反应中的能量变化,通常表现为热量的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,其中氧化剂是MnO2,还原剂是HCl.
,其中氧化剂是MnO2,还原剂是HCl.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{53}^{131}{I}$的原子核内中子数多于质子数 | |
| B. | ${\;}_{53}^{131}{I}$的原子序数为131 | |
| C. | ${\;}_{53}^{131}{I}$的原子核外电子数为78 | |
| D. | ${\;}_{53}^{131}{I}$的化学性质与${\;}_{53}^{127}{I}$不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④ | B. | ②④ | C. | ①③④ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氨中含有H2O,NH3•H2O,NH3,NH4+,NH2-等微粒 | |
| B. | 液氨中c(NH4+)•c(NH2-)是一个随温度升高而减小的常数 | |
| C. | 液氨的电离达到平衡时c(NH3)=c(NH4+)=c(NH2-) | |
| D. | 任何温度下,只要不加入其他物质,液氨中c(NH4+)和c(NH2-)一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
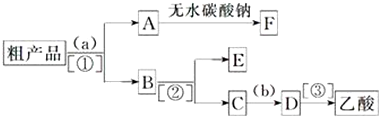
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com