
【题目】某化学兴趣小组要完成中和热的测定实验.
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、量筒、稀盐酸(0.5molL﹣1)、稀 NaOH溶液(0.55molL﹣1),尚缺少的实验玻璃用品是、 .
(2)写出表示稀盐酸和稀氢氧化钠溶液反应中和热的热化学方程式(中和热为57.3kJmol﹣1): .
(3)若用稀醋酸、稀硫酸、浓硫酸分别和稀氢氧化钠溶液反应来测定中和热,恰好完全反应时对应的热效应分别为△H1、△H2、△H3的大小关系是 .
(4)每组实验所用氢氧化钠溶液和稀盐酸的体积均为 50mL,可近似认为该实验中稀盐酸和稀氢氧化钠溶液的密度均为 1g/cm3,中和后生成溶液的比热容c=4.18J/(g℃),实验中记录数据如表所示,请填写表中空白:
编号 | 起始温度T1/℃ | 终止温度T2/℃ | 平均温度差T2﹣T1/℃ | △H | ||
盐酸 | NaOH | 平均值 | ||||
① | 26.2 | 26.0 | 26.1 | 29.2 |
|
|
② | 25.9 | 25.9 | 25.9 | 29.2 | ||
③ | 26.4 | 26.2 | 26.3 | 29.5 | ||
【答案】
(1)环形玻璃搅拌棒;温度计
(2)HCl(aq)+NaOH(aq)═NaCl(aq)+H2O(l)△H=﹣57.3 kJ?mol﹣1
(3)△H1>△H2>△H3
(4)3.2|﹣53.5kJ/mol
【解析】解:(1)中和热的测定过程中,需要大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、量筒、环形玻璃搅拌棒和温度计,根据所给的仪器,可知还缺少的玻璃仪器为:环形玻璃搅拌棒和温度计;
所以答案是:环形玻璃搅拌棒、温度计;(2)稀盐酸和稀氢氧化钠溶液反应的中和热△H=﹣57.3kJmol﹣1,即HCl和NaOH反应生成1mol水放出57.3kJ的热量,表示中和热的热化学方程式为:HCl(aq)+NaOH(aq)═NaCl(aq)+H2O(l)△H=﹣57.3 kJmol﹣1
所以答案是:HCl(aq)+NaOH(aq)═NaCl(aq)+H2O(l)△H=﹣57.3 kJmol﹣1;(3)强酸与强碱的稀溶液发生中和反应热效应表示为:H+(aq)+OH﹣(aq)═H2O(l)△H=﹣57.3KJmol﹣1,若用稀醋酸、稀硫酸、浓硫酸分别和稀氢氧化钠溶液反应来测定中和热,因浓硫酸溶于水放热,醋酸的电离吸热,则恰好完全反应时的放出的热量为:①<②<③,所以△H1>△H2>△H3;
所以答案是:△H1>△H2>△H3;(4)3次温度差分别为:3.2℃,3.1℃,3.3℃,均有效,三次温度差平均值= ![]() =3.2℃;
=3.2℃;
50mL 0.55mol/L NaOH溶液和50mL 0.5mol/L盐酸溶液进行中和反应生成水的物质的量为0.05L×0.5mol/L=0.025mol,溶液的质量为:100ml×1g/cm3=100g,温度变化的值为△T=3.2℃,则生成0.025mol水放出的热量为Q=mc△T=100g×4.18J/(g℃)×3.2℃=1337.6J,即1.3376KJ,所以实验测得的中和热△H= ![]() =﹣53.5kJ/mol;
=﹣53.5kJ/mol;
所以答案是:3.2;﹣53.5kJ/mol.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
【题目】化学反应的快慢和限度对人类生产、生活有重要的意义。
(1)将影响化学反应速率的因素镇在空格处。
实例 | 影响因素 |
食物放在冰箱里延长保质期 | ①___ |
实验室将块状药品研细,再进行反应 | ②___ |
(2)某小组将酸性KMnO4溶液与H2C2O4(具有还原性)溶液混合,用反应中溶液紫色消失快慢的方法研究形响化学反应速率的因素。实验中酸性KMnO4溶液(0.0010mol/L)、H2C2O4溶液的用量均为4mL(忽略加入固体,溶液混合时体积的变化)。
①该反应中氧化剂与还原剂的物质的量之比为________。
②请帮助他们完成以下实验设计表:填写IV中的数据,并将实验目的补充完整。
实验编号 | 温度/K | 催化剂的用量/g | H2C2O4溶液的浓度/mol.L-1 | 实验目的 |
I | 298 | 0.5 | 0.010 | A.实验I和II探究____对反应速率的影响 B.实验I和III探究____对反应速率的影响 C.实验I和IV探究催化剂对反应速率的影响 |
II | 298 | 0.5 | 0.050 | |
III | 323 | 0.5 | 0.010 | |
IV | ____ | ____ | ____ |
③该小组同学对实验II进行了3次实验,测得以下数据:
实验编号 | 溶液退色所需时问t/min | ||
第1次 | 第2次 | 第3次 | |
II | 4.9 | 5.1 | 5.0 |
实验II中用KMnO4表示该反应的平均反应速率为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M代表四种金属元素,金属X和Z用导线连接放入稀硫酸中时,Z极上有H2放出;若把活泼金属投入Y2+和Z2+共存的溶液时,Y先析出;又知M2+的氧化性强于Y2+。则这四种金属的活动性最弱和最强的为( )
A.M;XB.X;MC.M;YD.X;Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.合成高分子材料包括塑料、合成纤维、合成橡胶、黏合剂、涂料等
B.用木材等经过加工制成的黏胶纤维属于合成纤维
C.棉花、羊毛和天然橡胶是有机高分子材料
D.合成橡胶的原料是煤、石油、天然气和农副产品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有两种溶质NaCl和H2SO4 , 物质的量之比为3:1.用石墨作电极电解溶液,根据电极产物,可明显分为三个阶段.下列叙述不正确的是( )
A.阴极只析出H2
B.阳极先析出Cl2 , 后析出O2
C.电解最后阶段为电解水
D.溶液pH不断增大,最后为7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学校化学兴趣小组为探索金属回收物的综合利用,专门设计实验用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体(FeSO4·7H2O)和胆矾晶体(CuSO4·5H2O),其实验方案如下:
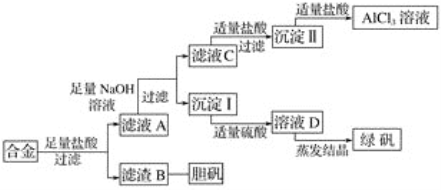
请回答下列问题:
(1)过滤用的玻璃仪器有________。
(2)小组成员经过检测,发现制得的绿矾不纯,试分析原因:_____________________________,要想由沉淀I最终制得纯度较高的绿矾,应如何改进:______________________________________________________。
(3)小组成员从资料中获知H2O2是一种绿色氧化剂,在滤渣B中加入稀硫酸和H2O2可以使B溶解,则该反应的化学方程式为____________________________________________________。
(4)有同学提出可将方案中最初溶解合金的盐酸改用烧碱,重新设计方案,也能最终制得三种物质,你认为后者方案相对于前者方案________(填“更合理”或“不合理”),理由是________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体碘化铵置于密闭容器中,加热至一定温度后恒温;容器中发生反应:①NH4I(s)![]() NH3(g)+HI(g)②2HI(g)
NH3(g)+HI(g)②2HI(g)![]() H2(g)+I2(g),测得平衡时c(H2)=0.5mol/L,反应①的平衡常数为20,则下列结论正确的是 ( )
H2(g)+I2(g),测得平衡时c(H2)=0.5mol/L,反应①的平衡常数为20,则下列结论正确的是 ( )
A. 平衡时HI分解率为20%
B. 当固体碘化铵物质的量增大一倍,则在相同条件下,容器内压强变大
C. 固体碘化铵一定完全分解
D. 平衡时C(HI)=5mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组探究铁和硝酸银溶液的反应,实验过程如下:
实验序号 | 实验操作 | 实验现象 |
I | 将一束光亮洁净的铁丝伸入到0.1mol/L 的AgNO3溶液中 | 铁丝表面有银白色固体析出,溶液逐渐变为浅绿色 |
II | 取少量实验I中上层清液,滴入K3[Fe(CN) 6]溶液 | 有蓝色沉淀生成 |
(1)根据上述实验现象,甲同学认为有Fe2+生成,铁和硝酸银溶液的反应的离子方程式是____________________。
(2)乙同学认为实验中可能生成Fe3+,设计并完成如下实验
实验序号 | 实验操作 | 实验现象 |
III | 取少量实验I中上层清液,滴入少量KSCN溶液,振荡 | 产生白色沉淀,溶液局部变红,振荡后红色消失,沉淀量增加 |
查阅资料:Ag+与SCN-生成白色沉淀AgSCN
乙同学判断有Fe3+,理由是 ____________________。
(3)乙同学继续探究红色褪去的原因,设计并完成如下实验
实验序号 | 实验操作 | 实验现象 |
IV | 取少量实验I中上层清液,滴加几滴稀盐酸 | 有白色沉淀生成 |
V | 取1mLFe(NO3)3溶液,滴加2滴等浓度的KSCN溶液,振荡,再滴加少量AgNO3溶液 | 溶液变红;振荡溶液颜色无变化,滴加AgNO3后溶液红色褪去,产生白色沉淀. |
① 实验IV的目的是____________________;
② 用平衡移动原理解释,实验V中溶液红色褪去的原因____________________。
(4)丙认为溶液中Fe3+是Fe2+被Ag+氧化所致。按下图连接装置并进行实验,一段时间后取出左侧烧杯溶液加入KSCN溶液,溶液变红
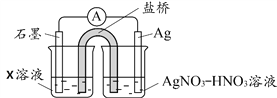
① 其中X溶液是____________________;
② 由实验得出Ag+和Fe2+反应的离子方程式是____________________;
③ 丙同学的实验设计及结论是否合理,请说明理由____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com