
| A. | CH3OH的燃烧热为192.9kJ•mol-1 | |
| B. | CH3OH转变成H2的过程一定要吸收能量 | |
| C. | 可推知2H2(g)+O2(g)═2H2O(g)△H=-483.8 kJ/mol | |
| D. | 根据②推知反应:CH3OH(l)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)的△H<-192.9kJ•mol-1 |
分析 A、利用盖斯定律,②×3-①×2可得甲醇燃烧的热化学方程式,进而可知甲醇的燃烧热;
B、根据△H=生成物总能量-反应物总能量来判断;
C、根据物质的能量大小与物质的状态关系来判断;
D、根据物质的能量大小与物质的状态关系来判断.
解答 解:A、根据盖斯定律将,②×3-①×2可得:CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-192.9kJ/mol×3-49kJ/mol×2=-676.7kJ/mol,所以甲醇的燃烧热为676.7kJ/mol,故A错误;
B、反应①的△H>0,而图示的△H=生成物总能量-反应物总能量<0,故B错误;
C、同物质的量的同种物质,气态能量最高,其次液态能量,固态能量最低,由②推知反应:CH3OH(l)+$\frac{1}{2}$O2(g)=CO2(g)+2H2(g)的△H>-192.9kJ•mol-1,故C正确;
D、同物质的量的同种物质,气态能量最高,其次液态能量,固态能量最低,由②推知反应:CH3OH(l)+$\frac{1}{2}$O2(g)=CO2(g)+2H2(g)的△H>-192.9kJ•mol-1,故D错误;
故选C.
点评 本题考查化学反应的反应热的计算.注意在比较反应热大小时要带符号比较,并注意盖斯定律的应用来解答.


科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | M | N | P |
| 原子半径/nm | 0.186 | 0.143 | 0.075 | 0.074 | 0.152 | 0.099 |
| 元素的主要化合价 | +1 | +3 | +5、-3 | -2 | +1 | +7、-1 |
| A. | X、N元素的金属性:X>N | |
| B. | Y、M元素形成的离子化合物是工业冶炼Y的原料 | |
| C. | X单质在M单质中燃烧生成的化合物39g中共含有0.5NA个阴离子 | |
| D. | 表中Z元素的最高价氧化物的水化物的分子式可表示为H3ZO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X元素原子的电子层数比Y元素原子的电子层数多 | |
| B. | X的气态氢化物比Y的气态氢化物稳定 | |
| C. | X的最高价氧化物对应水化物的酸性比Y的弱 | |
| D. | Y的单质能将X从NaX溶液中置换出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 还原性强弱:CI-<Br一<I - | B. | 微粒半径大小:S>Na+>O2- | ||
| C. | 热稳定性:HF>H2O>NH3 | D. | 碱性:KOH>NaOH>LiOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制取溴苯:铁屑、溴水、苯 | |
| B. | 要检验卤代烃中的卤素原子,可向其溶液中加入AgNO3溶液 | |
| C. | 苯酚有酸性,可使紫色石蕊变红 | |
| D. | 用溴水可鉴别苯、CCl4、苯乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
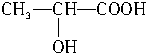
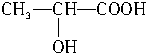 +NaHCO3→
+NaHCO3→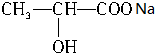 +CO2↑+H2O
+CO2↑+H2O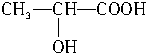 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$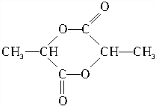 +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2S和NH3均是价电子总数为8的分子 | |
| B. | HS-和HCl均是含一个极性键的18电子粒子 | |
| C. | CO2的电子式为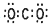 | |
| D. | 1 mol D216O中含中子、质子、电子各10 NA(NA代表阿伏加德罗常数的值) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
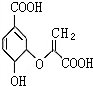 分支酸在植物的芳香族氨基酸的合成系统中作为中间体,其结构简式如图.下列关于分支酸的叙述正确的是( )
分支酸在植物的芳香族氨基酸的合成系统中作为中间体,其结构简式如图.下列关于分支酸的叙述正确的是( )| A. | 分支酸属于芳香族化合物 | |
| B. | 遇氯化铁溶液发生显色反应,可用于检验分支酸 | |
| C. | 1 mol分支酸最多可与3molH2发生加成反应 | |
| D. | 1 mol分支酸与足量NaHCO3溶液反应放出67.2L二氧化碳气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com