
【题目】工业上以铬铁矿(主要成分为FeO·Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7·2H2O),其主要反应为:
⑴4FeO·Cr2O3+8Na2CO3+7O2 ![]() 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
⑵2Na2CrO4+H2SO4![]() Na2SO4+Na2Cr2O7+H2O
Na2SO4+Na2Cr2O7+H2O
下列说法中正确的是
A.反应⑴和⑵均为氧化还原反应
B.反应⑴的氧化剂是O2,还原剂是FeO·Cr2O3
C.高温下,O2的氧化性大于Fe2O3小于Na2CrO4
D.生成1mol的Na2Cr2O7时共转移7mol电子
【答案】BD
【解析】
A、4FeO·Cr2O3+8Na2CO3+7O2 ![]() 8Na2CrO4+2Fe2O3+8CO2中有元素化合价的变化,所以是氧化还原反应,而2Na2CrO4+H2SO4
8Na2CrO4+2Fe2O3+8CO2中有元素化合价的变化,所以是氧化还原反应,而2Na2CrO4+H2SO4![]() Na2SO4+Na2Cr2O7+H2O中没有元素化合价的变化,所以不是氧化还原反应,故A错误;
Na2SO4+Na2Cr2O7+H2O中没有元素化合价的变化,所以不是氧化还原反应,故A错误;
B、4FeO·Cr2O3+8Na2CO3+7O2 ![]() 8Na2CrO4+2Fe2O3+8CO2中,氧气中氧元素得电子化合价降低,所以氧化剂是氧气,铁元素和铬元素失电子化合价升高,所以还原剂是FeO·Cr2O3,故B正确;
8Na2CrO4+2Fe2O3+8CO2中,氧气中氧元素得电子化合价降低,所以氧化剂是氧气,铁元素和铬元素失电子化合价升高,所以还原剂是FeO·Cr2O3,故B正确;
C、4FeO·Cr2O3+8Na2CO3+7O2 ![]() 8Na2CrO4+2Fe2O3+8CO2中,氧化剂是氧气,还原剂是FeO·Cr2O3,所以氧气的氧化性大于Na2CrO4和Fe2O3,但不能判断Na2CrO4和Fe2O3的氧化性相对强弱,故C错误;
8Na2CrO4+2Fe2O3+8CO2中,氧化剂是氧气,还原剂是FeO·Cr2O3,所以氧气的氧化性大于Na2CrO4和Fe2O3,但不能判断Na2CrO4和Fe2O3的氧化性相对强弱,故C错误;
D、由方程式4FeO·Cr2O3+8Na2CO3+7O2 ![]() 8Na2CrO4+2Fe2O3+8CO2转移电子可知,生成1mol Na2CrO4时,参加反应的O2的物质的量为
8Na2CrO4+2Fe2O3+8CO2转移电子可知,生成1mol Na2CrO4时,参加反应的O2的物质的量为![]() mol,反应中O元素由0价降低为-2价,电子转移的物质的量为参加反应的氧气的物质的量的4倍,转移电子的物质的量为
mol,反应中O元素由0价降低为-2价,电子转移的物质的量为参加反应的氧气的物质的量的4倍,转移电子的物质的量为![]() mol×4=3.5mol,所以反应(1)中每生成1mol Na2CrO4时电子转移3.5mol,反应(2)不是氧化还原反应,所以生成1mol的Na2Cr2O7时转移7mol电子,故D正确;
mol×4=3.5mol,所以反应(1)中每生成1mol Na2CrO4时电子转移3.5mol,反应(2)不是氧化还原反应,所以生成1mol的Na2Cr2O7时转移7mol电子,故D正确;
故选BD。


科目:高中化学 来源: 题型:
【题目】下列各对物质中,互为同系物的是( )
A.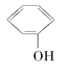 与
与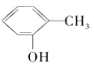
B.HCOOCH3与CH3CH2COOH
C.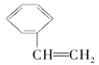 与CH3-CH=CH2
与CH3-CH=CH2
D.C6H5OH与C6H5CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)①25 ℃时,NaHCO3溶液呈碱性,原因是_________水解引起的(填“Na+”或 “HCO3-”);
②常温下,0.0100 mol/L盐酸的pH=__________
③用0.0100 mol/L盐酸滴定未知浓度的NaOH溶液,酚酞作指示剂,滴定终点时, 溶液的颜色由红色变为__________(填“蓝色”或“无色”),且半分钟内保持不变。
(2)在某密闭容器中进行可逆反应:FeO(s)+CO(g)![]() Fe(s)+CO2(g) ΔH>0平衡常数表达式为K=c(CO2)/c(CO)。
Fe(s)+CO2(g) ΔH>0平衡常数表达式为K=c(CO2)/c(CO)。
①反应达到平衡后,向容器中通入CO,化学平衡向____方向移动(填“正反应”或“逆反应”);
②若升高温度,平衡常数K__________(填“增大”、“减小”或“不变”);
③查阅资料得知1 100℃时K=0.263。某时刻测得容器中c(CO2)=0.025 mol/L,c(CO)=0.10 mol/L,此时刻反应__________平衡状态(填“达到”或“未达到”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各实验中所选用的实验仪器不能都用到的是
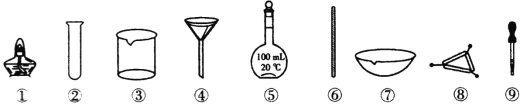
A.除去Na2CO3溶液中的CaCO3,选用③、④和⑥
B.NaC1溶液的蒸发结晶,选用①、⑥和⑦
C.配制100mL 0.1mol·L-1的NaOH溶液,选用③、⑤、⑥和⑨
D.将海带灼烧灰化,选用①、⑦和⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列离子晶体的空间结构示意图。图中●和化学式中M分别代表阳离子,图中○和化学式中N分别代表阴离子,则化学式为MN2的晶体结构为
A.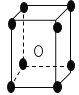 B.
B.
C.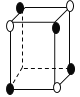 D.
D.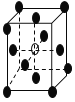
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:
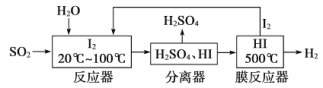
下列说法正确的是
A.分离器中的物质分离操作为过滤
B.反应器中,控制温度为20-100℃,温度过低速率慢,过高水气化且增大碘的流失,反应速率也慢
C.该工艺中I2和HI的相互转化体现了“碘循环”
D.碘循环工艺的总反应为2SO2+4H2O+I2=H2+2H2SO4+2HI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醛(HCHO)俗称蚁醛,是一种重要的化工原料。可通过以下方法将甲醇转化为甲醛。
脱氢法:CH3OH(g)=HCHO(g)+H2(g) ΔH1=+92.09 kJ·mol-1
氧化法:CH3OH(g)+![]() O2(g)=HCHO(g)+H2O(g)ΔH2
O2(g)=HCHO(g)+H2O(g)ΔH2
回答下列问题:
(1)已知:2H2(g)+O2(g)=2H2O(g)ΔH3=-483.64 kJ·mol-1,则ΔH2=_________________。
(2)与脱氢法相比,氧化法在热力学上趋势较大,其原因为________________________________________。
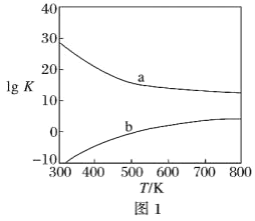
(3)图1为甲醇制备甲醛反应的lg K(K为平衡常数)随温度(T)的变化曲线。曲线_____(填“a”或“b”)对应脱氢法,判断依据是_____________________________________。
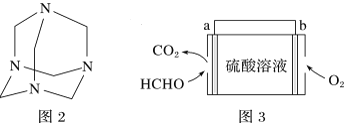
(4)将甲醛水溶液与氨水混合蒸发可制得乌洛托品(结构简式如图2),该物质在医药等工业中有广泛用途。若原料完全反应生成乌洛托品,则甲醛与氨的物质的量之比为___________。
(5)室内甲醛超标会危害人体健康,通过传感器可以监测空气中甲醛的含量。一种燃料电池型甲醛气体传感器的原理如图3所示,则a极的电极反应式为_________________________________________________,当电路中转移4×10-4 mol电子时,传感器内参加反应的HCHO为________________mg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法正确的是( )
A.含5个碳原子的有机物分子中最多可形成4个碳碳单键
B.蛋白质的水解和油脂的皂化都是由高分子生成小分子的过程
C.四苯基乙烯(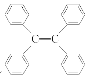 )所有碳原子一定处于同一平面
)所有碳原子一定处于同一平面
D.化学式为![]() 且有芳香气味的有机物,在酸性条件下加热水解产生相对分子质量相同的两种有机物,则符合此条件的
且有芳香气味的有机物,在酸性条件下加热水解产生相对分子质量相同的两种有机物,则符合此条件的![]() 的结构有16种
的结构有16种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,将一块铁溶于800mL1mol/L的稀硫酸溶液中,反应完全,求:
(1)所溶解铁的质量为多少____?
(2)产生的H2的体积为多少____?
(3)完全反应后,硫酸亚铁的浓度是多少____?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com