
在溶液中有浓度均为0.01 mol·L-1的Fe3+、Cr3+、Zn2+、Mg2+等离子,已知:Ksp[Fe(OH)3]=2.6×10-39;Ksp[Cr(OH)3]=7.0×10-31;Ksp[Zn(OH)2]=1.0×10-17;Ksp[Mg(OH)2]=1.8×10-11。当氢氧化物开始沉淀时,下列离子中所需pH最小的是( )
A.Fe3+ B.Cr3+ C.Zn2+ D.Mg2+
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
固体电解质(高温下能传导O2-)
负极:________________________________________________________________________;
正极:________________________________________________________________________;
总反应式:_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)“纳米材料”是当今材料科学研究的前沿,其研究成果广泛应用于催化及军事科学中。所谓“纳米材料”是指研究、开发出的微粒粒度从几纳米至几十纳米的材料,如将纳米材料分散到分散剂中,所得混合物可能具有的性质是______。
A.能全部透过半透膜
B.有丁达尔效应
C.所得液体呈胶状
D.所得物质一定是悬浊液
(2)把淀粉溶液溶于沸水中,制成淀粉胶体,回答下列问题。
①鉴别水溶液和胶体可以利用的方法是__________________________________________________
__________________________________________________。
②60℃左右时,在淀粉胶体中加入淀粉酶,装入半透膜袋里,系紧袋口,并把它悬挂在盛有蒸镏水的烧杯里充分反应。从半透膜里析出的物质是____________,该操作的名称是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
判断正误,正确的划“√”,错误的划“×”
(1)Ca(OH)2能制成澄清石灰水,所以可配制2.0 mol·L-1的Ca(OH)2溶液( )
(2014·广东理综,9D)
(2)溶解度小的沉淀易向溶解度更小的沉淀转化,所以ZnS沉淀中滴加CuSO4溶液可以得到CuS沉淀( )
(2014·安徽理综,12D)
(3)验证Fe(OH)3的溶解度小于Mg(OH)2,可将FeCl3溶液加入Mg(OH)2悬浊液中,振荡,可观察到沉淀由白色变为红褐色( )
(2014·四川理综,4D)
(4)25 ℃时Cu(OH)2在水中的溶解度大于其在Cu(NO3)2溶液中的溶解度( )
(2014·重庆理综,3D)
(5)AgCl沉淀易转化为AgI沉淀且K(AgX)=c(Ag+)·c(X-),故K(AgI)<K(AgCl)( )
(2013·重庆理综,2D)
(6)CaCO3难溶于稀硫酸,也难溶于醋酸( )
(2013·天津理综,5B)
(7)饱和石灰水中加入少量CaO,恢复至室温后溶液的pH不变( )
(2012·重庆理综,10C)
(8)在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大( )
(2012·天津理综,5B)
(9)AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同( )
(2010·天津理综,4C)
查看答案和解析>>
科目:高中化学 来源: 题型:
已知25 ℃时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应Fe(OH)3+3H+Fe3++3H2O的平衡常数K=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知25 ℃时,难溶化合物的饱和溶液中存在着溶解平衡,例如:AgCl(s)Ag+(aq)+Cl-(aq),Ag2CrO4(s)2Ag+(aq)+CrO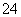 (aq),且Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.9×10-12。
(aq),且Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.9×10-12。
(1)若把足量的AgCl分别放入①100 mL蒸馏水,②100 mL 0.1 mol·L-1 NaCl溶液,③100 mL 0.1 mol·L-1 AlCl3溶液,④100 mL 0.1 mol·L-1 MgCl2溶液中,搅拌后在相同温度下Ag+浓度由大到小的顺序是____________________________(填序号)。
(2)现用0.001 mol·L-1 AgNO3溶液滴定0.001 mol·L-1 KCl和0.001 mol·L-1 K2CrO4的混合溶液,试通过计算回答:Cl-和CrO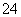 中哪种先沉淀?________。
中哪种先沉淀?________。
查看答案和解析>>
科目:高中化学 来源: 题型:
( 在5-氨基四唑(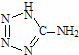 )中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊。
)中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊。
(1)基态Ga原子的电子排布式可表示为 ;
(2)5-氨基四唑中所含元素的电负性由大到小的顺序为 ;
在1mol 5-氨基四唑中含有的σ键的数目为 。
(3)叠氮酸钠(NaN3)是传统家用汽车安全气囊中使用的气体发生剂。
①叠氮酸钠(NaN3)中含有叠氮酸根离子(N3-),根据等电子体原理N3-的空间构型为 。②以四氯化钛、碳化钙、叠氮酸盐作原料,可以生成碳氮化钛化合物。其结构是用碳原子取代氮化钛晶胞(结构如上图示)顶点的氮原子,这种碳氮化钛化合物的化学式为 。
③与钛同周期的所有元素的基态原子中,未成对电子数与钛相同的元素有 。(填写元素符号)
④ [Ti(OH)2(H2O)4]2+中的化学键有 。
A.σ键 B.π键 C.离子键 D.配位键

查看答案和解析>>
科目:高中化学 来源: 题型:
实验室用锌粒与V mL浓度为10%的稀硫酸反应制取氢气,若向反应混合物中加入下列物质,关于反应速率v说法正确的是( )
A.少量Na2SO4固体,v(H2)减小
B.V mL BaCl2溶液,v(H2)不变
C.加入细小的碳粒,v(H2)增大
D.加入NH4HSO4固体,v(H2)不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com