
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
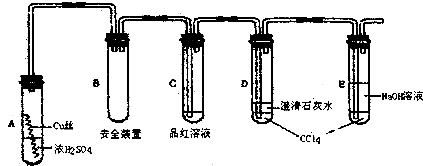

查看答案和解析>>
科目:高中化学 来源:走向清华北大同步导读·高一化学 题型:013
在铜与浓H2SO4的反应中,如果电子转移0.4mol,则被还原硫酸物质的量是
[ ]
A.0.4mol B.0.2mol C.2mol D.4mol
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:013
A.0.4 mol B.0.2 mol
C.2 mol D.4 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com