
下列叙述正确的是 ( )
A.1mol SO42- 的质量是96 g B.1mol H2O的质量是18 g/mol
C.CO2的摩尔质量是44 g D.HCl的相对分子质量是36.5 g/mol
科目:高中化学 来源:2017届山东省高三上学期开学考试化学试卷(解析版) 题型:实验题
实验室制备苯甲醇和苯甲酸的化学原理是:
2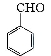 +KOH
+KOH
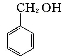 +
+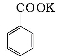 ;
; +HCl
+HCl
 +KCl
+KCl
制备苯甲醇和苯甲酸的主要过程如下:
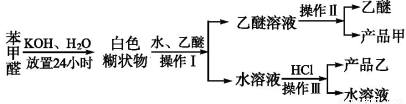
已知:苯甲醛易被空气氧化;苯甲醇的沸点为205.3 ℃;苯甲酸的熔点为121.7 ℃,沸点为249 ℃,溶解度为0.34 g;乙醚的沸点为34.8 ℃,难溶于水。
试根据上述信息回答下列问题:
(1)操作Ⅰ的名称是 ;
乙醚溶液中所溶解的主要成分是 (写名称,下同)。
(2)操作Ⅲ的名称是 ;产品乙是 。
(3)现有下图所示的四种装置,进行操作Ⅱ应选择的最合理装置是 (填序号);
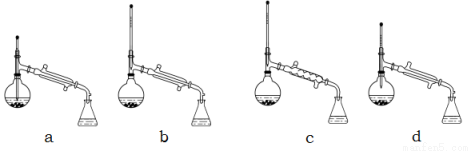
操作中还需要用到的的玻璃仪器是 ;得到的产品甲是在 中(写仪器名称)。
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上学期第一次月考化学试卷(解析版) 题型:选择题
将0.01mol下列物质分别加入100mL蒸馏水中,恢复至室温,所得溶液中阴离子浓度的大小顺序是(溶液体积变化忽略不计)( )
①Na2O2 ②Na2O ③Na2CO3 ④NaCl
A.①>②>③>④ B.①>②>④>③ C.①=②>③>④ D.①=②>③=④
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上学期周练(8.28)化学试卷(解析版) 题型:填空题
2006年6月,我国海域发生2次红潮事件,这与洗涤剂的使用有关。通常洗涤剂中含有三磷酸五钠(Na5P3O10)。洗涤衣物的废水如直接排放到河湖中会造成水质富营养化,促使藻类大量繁殖,藻类死亡后经氧化,消耗水中的氧气,造成水中缺氧致使河水变黑变臭,鱼类等水生生物因缺氧而死亡。
(1)经测定知,某藻类的组成为:含C 35.76%,含O 49.50%,含N 6.310%,含H 7.370%,含P 0.870%,计算该藻类中各元素原子个数比(相对一个P原子) ________。
(2)藻类被氧气完全氧化的化学方程式(藻类用“化学式”表示,生成物除O外都为最高价化合物)为_____________________________。
(3)现有一个面积为1×106 m2、深20 m的湖泊,含氧量为9.1 g/m3,若每天排入3%(质量分数)三磷酸五钠的废水1 000 kg,多少天后湖里的氧气被耗尽(设空气中的氧气不再溶入湖水中)。
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上学期周练(8.28)化学试卷(解析版) 题型:选择题
某元素原子的最外层上只有2个电子,该元素是( )
A. 一定是IIA元素 B. 一定是金属元素
C. 一定是正二价元素 D. 可能是金属元素,也可能是非金属元素
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上开学测化学试卷(解析版) 题型:实验题
过氧化钙微溶于水,溶于酸,可用作分析试剂、医用防腐剂、消毒剂.以下是一种制备过氧化钙的实验方法.回答下列问题:
(一)碳酸钙的制备
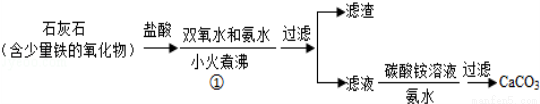
(1)步骤①加入氨水的目的是调节溶液pH使Fe(OH)3沉淀,小火煮沸的作用是使沉淀颗粒长大,有利于 。
(2)如图是某学生的过滤操作示意图,其操作不规范的是 (填标号)。
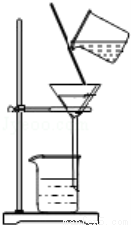
a.漏斗末端颈尖未紧靠烧杯壁
b.玻璃棒用作引流
c.将滤纸湿润,使其紧贴漏斗壁
d.滤纸边缘高出漏斗
e.用玻璃棒在漏斗中轻轻搅动以加过过滤速度
(二)过氧化钙的制备
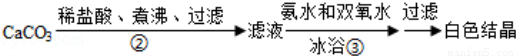
(3)步骤②的具体操作为逐滴加入稀盐酸,至溶液中尚存有少量固体,此时溶液呈 性(填“酸”、“碱”或“中”)。将溶液煮沸,趁热过滤,将溶液煮沸的作用是 。
(4)步骤③中反应的化学方程CaCl2+2NH3.H2O+H2O2+6H2O=CaO2•8H2O↓+2NH4Cl该反应需要在冰浴下进行,原因是 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上开学测化学试卷(解析版) 题型:选择题
Mg﹣AgCl电池是一种以海水为电解质溶液的水激活电池.下列叙述错误的是
A.负极反应式为Mg﹣2e﹣=Mg2+
B.正极反应式为Ag++e﹣=Ag
C.电池放电时Cl﹣由正极向负极迁移
D.负极会发生副反应Mg+2H2O=Mg(OH)2+H2↑
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上开学测化学试卷(解析版) 题型:选择题
某元素的一种同位素X的原子质量数为A,含N个中子,它与1H原子组成HmX分子。在a g HmX中所含质子的物质的量是
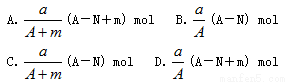
查看答案和解析>>
科目:高中化学 来源:2017届山西省等五校高三上学期第一次联考化学试卷(解析版) 题型:实验题
亚硝酸钠是一种工业盐,虽然和食盐很像,但有毒,不能食用。以下为亚硝酸钠的工业生产流程:

(1)首先在反应塔中通SO2和淋入硝酸,控制反应生成的NO与NO2物质的量之比恰好1:1,则分解塔中发生反应的化学方程式为: 。试从产物产率的角度分析该反应中硝酸的浓度不宜过大或过小的原因是 。
(2)吸收塔中所发生化学反应方程式为: 。
(3)为测定亚硝酸钠的含量,称取4.500 g样品溶于水配成250 mL溶液,取20.00 mL溶液于锥形瓶中,用0.1000 mol·L-1酸性KMnO4溶液进行滴定,实验所得数据如下表所示:

①锥形瓶中发生反应的离子方程式为 。
②第一组实验数据出现异常,造成这种异常的原因可能是_________(填代号)。
A.酸式滴定管用蒸馏水洗净后用标准液润洗
B.滴定终点时仰视读数
C.锥形瓶洗净后未干燥
③根据表中数据,计算所得固体中亚硝酸钠的质量分数__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com