
下列有关金属元素特征的叙述正确的是( )
A.金属元素的原子只有还原性,离子只有氧化性
B.金属元素一般在化合物中只显正价
C.金属元素在不同的化合物中的化合价均不同
D.金属元素的单质在常温下均为金属晶体
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
等离子体的用途十分广泛,运用等离子体束切割金属或者进行外科手术,利用了等离子体的特点是( )
A.微粒带有电荷 B.高能量
C.基本构成微粒多样化 D.准电中性
查看答案和解析>>
科目:高中化学 来源: 题型:
在第3周期各元素(稀有气体除外)中,原子半径最大的原子是________,其单质晶
体属于________晶体;原子半径最小的原子是________,其单质晶体属于________晶体,用电子式表示两元素形成化合物的过程:________________________________,该化合物的
晶体属于________晶体,最低负化合价的绝对值等于最高正化合价的原子是________,其单质晶体类型为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
| 化学键 | Si—O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能/kJ·mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
请回答下列问题:
(1)比较下列两组物质的熔点高低(填“>”或“<”)。
SiC________Si;SiCl4________SiO2。
(2)下图立方体中心的“●”表示硅晶体中的一个原子,请在立方体的顶点用“●”表示出与之紧邻的硅原子。
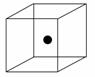
(3)工业上高纯硅可通过下列反应制取:
SiCl4(g)+2H2(g)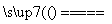 Si(s)+4HCl(g)
Si(s)+4HCl(g)
该反应的反应热ΔH=________kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关金属键的叙述错误的是( )
A.金属键没有饱和性和方向性
B.金属键是金属阳离子和自由电子之间存在的强烈的静电吸引作用
C.金属键中的电子属于整块金属
D.金属的性质和金属固体的形成都与金属键有关
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D分别代表四种不同的短周期元素。A元素的原子最外层电子排布为ns1,
B元素的原子价电子排布为ns2np2,C元素的最外层电子数是其电子层数的3倍,D元素原子的M电子层的p亚层中有1个电子。
(1)C原子的电子排布式为________________________________________________,
若A元素的原子最外层电子排布为1s1,则按原子轨道的重叠方式,A与C形成的化合
物中的共价键属于________键。
(2)当n=2时,B的原子结构示意图为__________,B与C形成的化合物晶体属于____________晶体。当n=3时,B与C形成的化合物的晶体中微粒间的作用力是_____。
(3)

若D元素与Fe形成某种晶体,该晶体的晶胞结构如右图所示,则晶体的化学式是___(用元素符号表示);若晶胞的边长为a nm,则合金的密度为______________g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
NaF、NaI、MgO晶体均为离子晶体,根据下列数据,这三种晶体的熔点高低顺序是( )
| 物质 | ①NaF | ②NaI | ③MgO |
| 离子电荷数 | 1 | 1 | 2 |
| 离子间距离/10-10m | 2.31 | 3.18 | 2.10 |
A.①>②>③ B.③>①>②
C.③>②>① D.②>①>③
查看答案和解析>>
科目:高中化学 来源: 题型:
下列指定微粒的个数比为2∶1的是( )
A.Be2+离子中的质子和电子
B.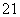 H原子中的中子和质子
H原子中的中子和质子
C.NaHCO3晶体中的阳离子和阴离子
D.BaO2(过氧化钡)固体中的阴离子和阳离子
查看答案和解析>>
科目:高中化学 来源: 题型:
金属晶体中金属原子有三种常见的堆积方式:六方堆积、面心立方堆积和体心立方堆积。a、b、c分别代表这三种晶胞的结构,其晶胞a、b、c内金属原子个数比为( )
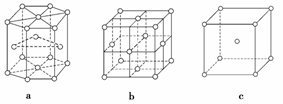
A.3∶2∶1 B.11∶8∶4
C.9∶8∶4 D.21∶14∶9
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com