
| A. | 原子的最外层电子数:X>Y>Z | B. | 单质沸点:Z>Y | ||
| C. | 离子半径:X2->Y+>Z- | D. | 原子序数:X>Y>Z |
分析 X、Z的最低价离子分别为X2-和Z-,则X为第ⅥA族元素,Z为ⅦA族元素;Y+和Z-具有相同的电子层结构,则Y在Z的下一周期,则Y为Na元素,Z为F元素,X、Y同周期,则X为S元素,结合元素在周期表中的位置以及元素周期律知识解答该题.
解答 解:X、Z的最低价离子分别为X2-和Z-,则X为第ⅥA族元素,Z为ⅦA族元素;Y+和Z-具有相同的电子层结构,则Y在Z的下一周期,则Y为Na元素,Z为F元素,X、Y同周期,则X为S元素.
A.X、Y、Z分别为S、Na、F,原子最外层电子数分别为6、1、7,故A错误;
B.常温下Na为固体,F2为气体,故沸点Na>F2,故B错误;
C.Na+、F-具有相同的核外电子排布,离子的核电荷数越大,离子半径越小,故离子半径:F->Na+,S2-离子比Na+、F-离子多1个电子层,离子半径最大,即离子半径:S2->F->Na+,故C错误;
D.X、Y、Z原子序数分别为16、11、9,原子序数:X>Y>Z,故D正确.
故选D.
点评 本题考查原子结构与元素周期律的关系,侧重于学生的分析能力的考查,难度不大,关键是根据原子结构特点正确推断元素的种类.


科目:高中化学 来源: 题型:解答题
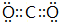 ,B与D形成的原子个数比为1:1的化合物的电子式是
,B与D形成的原子个数比为1:1的化合物的电子式是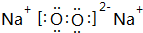 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
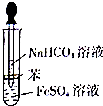 某校化学兴趣小组为探究FeSO4和NaHCO3的反应,按右图所示操作将NaHCO3溶液滴加到FeS04溶液中(FeS04和NaHCO3溶液均用经煮沸后冷却的蒸馏水配制,并在FeSO4溶液中加入少量铁粉).观察到试管中立即出现白色沉淀,同时有大量无色气体生成.
某校化学兴趣小组为探究FeSO4和NaHCO3的反应,按右图所示操作将NaHCO3溶液滴加到FeS04溶液中(FeS04和NaHCO3溶液均用经煮沸后冷却的蒸馏水配制,并在FeSO4溶液中加入少量铁粉).观察到试管中立即出现白色沉淀,同时有大量无色气体生成.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 改善性能,增大用途 | |
| B. | 除去硫、磷和过多的碳,调整合金元素的含量 | |
| C. | 副产磷肥、水泥等 | |
| D. | 用红棕色炉气制取水煤气 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 、取代反应
、取代反应 、加聚反应
、加聚反应查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn2C | B. | Al4C3 | C. | Mg2C3 | D. | Li2C2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com