
将10molH2和5molN2放入容积为10L的密闭容器中,某温度下发生反应:3 H2 (g)+N2 (g)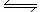 2NH3(g),在最初2s内,消耗H2的平均速率为0.06mol·L-1·s-1,则在这段时间内,用氨气表示的反应速率v(NH3)= __ mol·L-1·s-1 ; 2s时,容器中有________mol H2,此时NH3的物质的量浓度为______ mol·L-1·s-1;推测1s时n(NH3) 0.4moL(填“<”、“>”或“=”)
2NH3(g),在最初2s内,消耗H2的平均速率为0.06mol·L-1·s-1,则在这段时间内,用氨气表示的反应速率v(NH3)= __ mol·L-1·s-1 ; 2s时,容器中有________mol H2,此时NH3的物质的量浓度为______ mol·L-1·s-1;推测1s时n(NH3) 0.4moL(填“<”、“>”或“=”)
科目:高中化学 来源: 题型:
已知五种短周期元素的原子半径及主要化合价如下表:
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.104 | 0.111 | 0.066 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
下列叙述正确的是( )
A.L与T形成的化合物属于共价化合物 B.M的最高价氧化物的水化物具有两性
C.T、Q的氢化物常温常压下均为无色气体 D.L、M的单质与稀盐酸反应速率:M>L
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关说法正确的是( )。
A.H2SO4的酸性比HClO的酸性强,所以S的非金属性比Cl强
B.Mg (OH)2是中强碱,Al(OH)3是两性氢氧化物,所以Al比Mg活泼
C.H2S 300℃时开始分解,H2O 1000℃时开始分解,说明O的非金属性比S强
D.Na和Mg与酸都能激烈反应放出氢气,故无法比较它们的金属性强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不能作为比较卤族元素非金属强弱依据的是
A.F2、Cl2、Br2、I2跟氢气反应的激烈程度逐渐减小
B.HF、HCl、HBr、HI的热稳定性依次减小
C.F-、Cl-、Br-、I-的还原性依次增强
D.HF、HCl、HBr、HI水溶液的酸性依次增强
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.0.1 mol·L-1 Fe(NO3)2溶液:Mg2+、H+、SO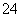 、Cl-
、Cl-
B.0.1 mol·L-1 Ag(NH3)2OH溶液:Na+、H+、Cl-、NO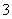
C.与金属铝能产生大量H2的溶液:K+、Na+、HCO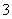 、NO
、NO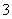
D.c(H+)+c(OH-)=2×10-7 mol·L-1的溶液:K+、Na+、Br-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
下列图示与对应的叙述不相符的是( )
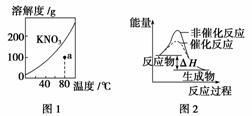
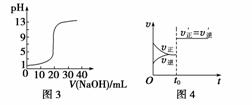
A.图1表示KNO3的溶解度曲线,图中a点所示的溶液是80 ℃时KNO3的不饱和溶液
B.图2表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
C.图3表示0.100 0 mol·L-1 NaOH溶液滴定20.00 mL 0.100 0 mol·L-1醋酸溶液得到的滴定曲线
D.图4表示已达平衡的某反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件可能是增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法不正确的是( )
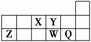
A.离子半径的大小顺序为r(W2-)>r(Q-)>r(Y2-)>r(Z3+)
B.元素W的最高价氧化物对应水化物的酸性比Q的强
C.元素X与Q的氢化物化合的产物中既含共价键又含离子键
D.X、Z、W、Q四种元素的最高价氧化物对应的水化物均能与强碱反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验现象可用同一原理解释的是( )
A.品红溶液中分别通入SO2和Cl2,溶液均褪色
B.溴水分别滴入植物油和裂化汽油中,溴水均褪色
C.鸡蛋白溶液中分别加入NaCl溶液和HgCl2溶液,均有固体析出
D.分别加热盛有NH4Cl和单质碘的试管,管口均有固体凝结
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com