
 按如图所示,两个烧杯中分别盛有足量的稀硫酸溶液和氯化铜溶液:
按如图所示,两个烧杯中分别盛有足量的稀硫酸溶液和氯化铜溶液:分析 (1)B有外接电源,属于电解池,A中Zn与硫酸反应,两个电极活性不同,且为闭合回路;
(2)A池中锌比铜活泼,所以铜是正极,锌是负极,正极电极反应式为:2H++2e-=H2↑;
(3)根据n=$\frac{m}{M}$计算Zn的物质的量,结合Zn元素化合价变化计算转移电子.
解答 解:(1)B有外接电源,属于电解池,A中Zn与硫酸反应,两个电极活性不同,且为闭合回路,构成原电池,故答案为:B;
(2)A池中锌比铜活泼,所以铜是正极,锌是负极,正极电极反应式为:2H++2e-=H2↑,故答案为:正,2H++2e-=H2↑;
(3)6.5Zn的物质的量为$\frac{6.5g}{65g/mol}$=0.1mol,反应中Zn元素化合价由0价升高为+2价,故转移电子为0.1mol×2=0.2mol,
故答案为:0.2.
点评 本题考查原电池与电解池,比较基础,注意理解掌握原电池与电解池工作原理,有利于基础知识的巩固.


科目:高中化学 来源: 题型:解答题
 和C3H8O3(甘油)以一定比例混合,测定混合物中含碳51.3%,那么氢元素的质量分数是8.7%(取2位有效数字,下同);氧元素的质量分数是40%.
和C3H8O3(甘油)以一定比例混合,测定混合物中含碳51.3%,那么氢元素的质量分数是8.7%(取2位有效数字,下同);氧元素的质量分数是40%.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
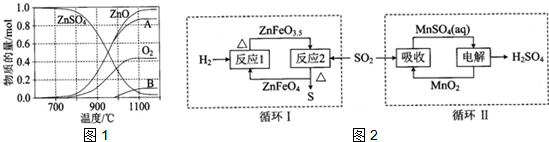
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 实验目的 | 反应物 | 反应前 溶液的pH | 温度 |
| 1 | 对照组 | O3+NaI+H2SO4 | 5.2 | 25℃ |
| 2 | ①探究FeCl2对反应速率的影响 | O3+NaI+H2SO4+FeCl2 | 5.2 | 25℃ |
| 3 | 探究温度对反应速率的影响 | O3+NaI+H2SO4 | ②5.2 | 5℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | A | B | D | E | G | I | J | K |
| 化合价 | -1 | -2 | +4 -4 | +7 -1 | +5 -3 | +3 | +2 | +1 |
| 原子半径/nm | 0.071 | 0.074 | 0.077 | 0.099 | 0.110 | 0.143 | 0.160 | 0.186 |
| A. | A的单质是一种常见的还原剂 | |
| B. | A、I、J的离子半径由大到小顺序是A>J>I | |
| C. | G元素的单质不存在同素异形体 | |
| D. | J在DB2中燃烧生成两种化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
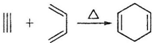 ,如果合成
,如果合成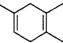 ,所用原始原料可以是( )
,所用原始原料可以是( )| A. | 3-甲基-l,3-丁二烯和3-丁炔 | B. | 1,3-戊二烯和2-丁炔 | ||
| C. | 2,3-二甲基-1,3-戊二烯和乙炔 | D. | 2,3-二甲基-l,3-丁二烯和丙炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
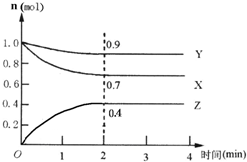 某可逆反应在某体积为5L的密闭容器中进行,在从0~4分钟各物质的量的变化情况如图所示(X、Y、Z均为气体).
某可逆反应在某体积为5L的密闭容器中进行,在从0~4分钟各物质的量的变化情况如图所示(X、Y、Z均为气体).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com