
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:
根据氨气还原氧化铜的反应,可设计测定铜元素相对原子质量么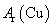 (近似值)的实验。先称量反应物氧化铜的质量m(CuO),反应完全后测定生成物水的质量m(H20),由此计算
(近似值)的实验。先称量反应物氧化铜的质量m(CuO),反应完全后测定生成物水的质量m(H20),由此计算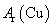 。为此,提供的实验仪器及试剂如下(根据需要可重复选用,加入的NH4C1与Ca(OH)2的量足以产生使CuO完全还原的氨气):
。为此,提供的实验仪器及试剂如下(根据需要可重复选用,加入的NH4C1与Ca(OH)2的量足以产生使CuO完全还原的氨气):



请回答下列问题:
(1)氨气还原炽热氧化铜的化学方程式为________________________________;
(2)从所提供的仪器及试剂中选择并组装本实验的一套合理、简单的装置,按气流方向的连接顺序为(用图中标注的导管口符号表示)a→________________;
(3)在本实验中,若测得m(CuO)= a g,m(H2O)= b g,则Ar(Cu)= _______________;
(4)在本实验中,使测定结果Ar(Cu)偏大的是_______________ (填序号);
①Cu0未完全起反应 ② CuO不干燥
③Cu0中混有不反应的杂质 ④ 碱石灰不干燥
⑤NH4C1与Ca(OH)2混合物不干燥
(5)在本实验中,还可通过测定__________和________,或_________和________达到实验目的。
10.高纯MnCO3是制备高性能磁性材料的主要原料。实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下:

(1)制备MnSO4溶液:在烧瓶中(装置见上图)加入一定量MnO2和水,搅拌,通入SO2和N2混合气体,反应3h。停止通入SO2,继续反应片刻,过滤(已知MnO2+H2SO4=MnSO4+H2O)。
①石灰乳参与反应的化学方程式为 。
②反应过程中,为使SO2尽可能转化完全,在通入SO2和N2比例一定、不改变固液投料的条件下,可采取的合理措施有 、 。
③若实验中将N2换成空气,测得反应液中Mn2+、SO42-的浓度随反应时间t变化如上图。导致溶液中Mn2+、SO42-浓度变化产生明显差异的原因是 。
(2)制备高纯MnCO3固体:已知MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解;Mn(OH)2开始沉淀时pH=7.7。请补充由(1)制得的MnSO4溶液制备高纯MnCO3的操作步骤[实验中可选用的试剂:Ca(OH)2、NaHCO3、Na2CO3、C2H5OH]。
① ;② ;③ ;④ ;⑤低于100℃干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
右图是恒温下某化学反应的反应速率随反应时间变化的示意图。下列叙述与示意图不相符合的是( )

A.反应达平衡时,正反应速率和逆反应速率相等
B.该反应达到平衡态Ⅰ后,增大反应物浓度,平衡发生移动,达到平衡态Ⅱ
C.该反应达到平衡态Ⅰ后,减小反应物浓度,平衡发生移动,达到平衡态Ⅱ
D.同一种反应物在平衡态Ⅰ和平衡态Ⅱ时浓度不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,相同pH值的盐酸和醋酸溶液分别稀释,pH值随
溶液体积变化的曲线如右图所示。据图判断正确的是 ( )
A.Ⅱ为盐酸稀释时pH值变化曲线
B.b点溶液的导电性比c点溶液的导电性强
C.a点Kw的数值比c点Kw的数值大
D.b点酸的总浓度大于a点酸的总浓度

查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液可能含有Na+、Fe2+、Br-、CO32-、I-、SO32-六种离子中的几种①在该溶液中加入足量氯水后,有气泡产生,溶液呈橙黄色;②向橙黄色的溶液中加入BaC12溶液时无沉淀生成;③向淀粉溶液中滴加该橙黄色溶液未变蓝色,则在该溶液中肯定存在的离子组是
A.Na+、SO32-、I- B.Na+、Br-、CO32-
C.Fe2+、I-、SO32- D.Fe2+、CO32-、Br-
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验表述正确的是

A.图l:用于制取纯净的NO2气体 B.图2:用于研究温度对化学平衡的影响
C.图3:用于实验室Cl2的收集 D.图4:用于除去CO2气体中的HCl杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
下列陈述Ⅰ、Ⅱ正确并且有因果关系的是
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | Si有良好的半导体性能 | Si可用于制备光导纤维 |
| B | 铁比铜活泼 | 铜板上的铁钉在潮湿空气中容易生锈 |
| C | 蛋白质和淀粉都是高分子化合物 | 蛋白质和淀粉水解最终产物均是葡萄糖 |
| D | 汽油和植物油都属于烃 | 汽油和植物油都可以燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.HIO与HCN均为含有极性键的直线形极性分子
B.SiO2与C02均为每摩含有4×6.02×1023对共用电子对的酸性氧化物
C.Na2S浓溶液与稀盐酸分别滴加到饱和AgCl溶液中均一定有沉淀产生
D.明矾与离子交换树脂均能将海水进行淡化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com