
【题目】已知元素的原子序数,可以推断元素原子的( )
①质子数 ②核电荷数 ③核外电子数 ④原子半径
A. ①③B. ②③C. ①②③D. ②③④
科目:高中化学 来源: 题型:
【题目】元素铬(Cr)在自然界主要以+3价和+6价存在。
(1)+6价的Cr能引起细胞的突变而对人体不利,可用亚硫酸钠将其还原。离子反应方程式为:3SO32-+Cr2O72-+8H+===2Cr3++3SO42-+4H2O,该反应氧化剂和还原剂的物质的量之比为___________。
(2)工业上利用铬铁矿( FeO. Cr2O3)冶炼铬的工艺流程如图所示:
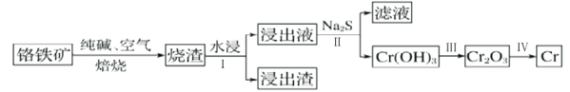
①为加快焙烧速率和提高原料的利用率,可采取的措施之一是___________。
②水浸Ⅰ要获得浸出液的操作是___________。
③浸出液的主要成分为Na2CrO4,加入Na2S反应后有Na2SO4生成,则操作Ⅱ发生反应的离子方程式为___________。
(3)常温下Cr(OH)3的溶度积Ksp=1×10-32,若要使Cr3+完全沉淀pH为___________[c(Cr3+)降至10-5mol·L-1可认为完全沉淀]。
(4)以铬酸钠(Na2CrO4)为原料,用电化学法可制备重铬酸钠(Na2Cr2O7),实验装置如图所示(已知:2CrO42-+2H+=Cr2O72-+H2O)。
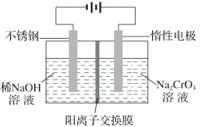
①阳极的电极反应式为___________。
②电解一段时间后,测得阳极区溶液中Na+物质的量由amol变为bmol,则生成重铬酸钠的物质的量为___________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学工作者研发了一种SUNCAT的系统,借助锂循环可持续合成氨,其原理如下图所示。下列说法不正确的是

A. 过程Ⅰ得到的Li3N中N元素为-3价
B. 过程Ⅱ生成W的反应:Li3N+3H2O===3LiOH+NH3↑
C. 过程Ⅲ中能量转化的形式:化学能转变为电能
D. 过程Ⅲ涉及到反应:4OH-4 e-=== O2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将浓度均为0.1mol/L、体积分别为Va和Vb的HA溶液与BOH 溶液按不同体积比混合,保持Va+Vb=100mL,Va、Vb与混合液的pH 的关系如图所示。下列说法正确的是
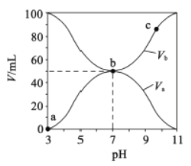
A. 由图可知BOH 一定是强碱 B. Ka(HA)=1×10-6mol/L
C. b点时,c(B-)=c(A-)=c(OH-)=c(H+) D. a→b过程中水的电离程度始终增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】澳大利亚研究人员开发出被称为第五形态的固体碳,这种新的碳结构称作纳米泡沫,它外形类似海绵,密度极小,并且有磁性。纳米泡沫碳与金刚石的关系是( )
A.同素异形体B.同分异构体
C.同位素D.同一物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜是一种重要的化工产品,常用作有机合成催化剂,还可用于颜料,防腐等工业。查阅资料得知:CuCl是一种白色固体,微溶于水,不溶于酒精,能溶于浓盐酸,其熔融物导电性很差。
(1)CuCl为__________(填“共价化合物”或“离子化合物”)。
(2)在CuCl2溶液中逐滴加入过量 KI溶液可能发生:
a.2Cu2++4I-=2CuI↓(白色)+I2
b.2Cu2++2Cl-+2I-=2CuCl↓(白色)+I2
若a反应为主要反应,则Ksp(CuI)________Ksp(CuCl)(填“>”、“<”或“=”=)
(3)实验室可用氯化铜溶液、铜粉、浓盐酸反应制备氯化亚铜,其反应原理和流程为:
CuCl2+Cu+2HCl(浓)![]() 2HCuCl2(无色)
2HCuCl2(无色)![]() 2CuCl↓(白色)+2HCl
2CuCl↓(白色)+2HCl
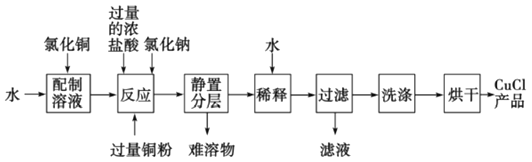
①上述反应流程中,加入氯化钠的目的是________________________。
②常温下,CuOH的Ksp为1.0×10-14,则Cu++H2O![]() CuOH+H+的平衡常数为:________
CuOH+H+的平衡常数为:________
③为得到纯净的CuCl晶体,最好选用__________(填编号)试剂进行洗涤。
a.蒸馏水 b.稀硫酸 c.氯化铜溶液 d.乙醇
④CuCl在潮湿的环境中易被氧化为Cu2(OH)3Cl,反应的化学方程式为__________。实验时,若用2mL0.5mol/L的CuCl2 溶液,最终可得到产品0.16g,则实验的产率为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2O4(g)![]() 2NO2(g)在温度为T1、T2(T1<T2)时达到平衡,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
2NO2(g)在温度为T1、T2(T1<T2)时达到平衡,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是

A. A、C两点的反应速率:A>C
B. B、C两点的气体的平均相对分子质量:B<C
C. A、C两点气体的颜色:A浅,C深
D. 保持容器体积不变,再充入NO2气体,NO2的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:H2(g)+![]() O2(g)=H2O(g) △H1
O2(g)=H2O(g) △H1
![]() N2(g)+O2(g)=NO2(g) △H2
N2(g)+O2(g)=NO2(g) △H2
![]() N2(g)+
N2(g)+![]() H2(g)=NH3(g) △H3
H2(g)=NH3(g) △H3
则反应2NH3(g)+![]() O2(g)=2NO2(g)+3H2O(g)的△H为
O2(g)=2NO2(g)+3H2O(g)的△H为
A. 2△H1+2△H2-2△H3 B. △H1+△H2-△H3
C. 3△H1+2△H2+2△H3 D. 3△H1+2△H2-2△H3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O5是一种新型硝化剂,在一定温度下可发生如下反应:2N2O5(g) ![]() 4NO2(g)+O2(g) ΔH>0。T1温度时,向密闭容器中通入N2O5气体,部分实验数据见下表:
4NO2(g)+O2(g) ΔH>0。T1温度时,向密闭容器中通入N2O5气体,部分实验数据见下表:
时间/s | 0 | 500 | 1 000 | 1 500 |
c(N2O5)/ mol·L-1 | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法正确的是
A. 500 s内NO2的生成速率为2.96×10-3 mol·L-1·s-1
B. T1温度下该反应平衡时NO2的产率为25%
C. 达到平衡后,其他条件不变,将容器的体积压缩到原来的1/2,则c(N2O5)<5.00 mol·L-1
D. T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1>K2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com