
| A. | SO2能使酸性KMnO4溶液、溴水、品红溶液褪色,且原理相同 | |
| B. | 不能用澄清石灰水鉴别SO2和CO2 | |
| C. | 硫粉在过量的纯氧中燃烧可以生成SO3 | |
| D. | 少量SO2通过浓的CaCl2溶液能生成白色沉淀 |
分析 A、根据二氧化硫具有还原性、漂白性的性质判断;
B、SO2与CO2均能使澄清的石灰水变浑浊;
C、硫粉在过量的纯氧中燃烧生成SO2;
D、SO2与CaCl2溶液不反应;
解答 解:A、二氧化硫具有还原性,可与酸性高锰酸钾和溴水发生氧化还原反应,具有漂白性,可使品红褪色,与品红是形成无色的不稳定性的大分子,是非氧化还原反应,原理不相同,故A错误;
B、SO2与CO2均能使澄清的石灰水变浑浊,所以不能用澄清石灰水鉴别SO2和CO2,故B正确;
C、硫粉在过量的纯氧中燃烧生成SO2;二氧化硫在催化剂和高温条件下才能转化为三氧化硫,故C错误;
D、SO2与CaCl2溶液不反应,所以少量SO2通过浓的CaCl2溶液不能生成白色沉淀,故D错误;
故选B.
点评 本题考查了元素单质及其化合物的性质和用途,掌握有关物质的性质是解决本题的关键,题目难度不大,注意基础知识的积累.


科目:高中化学 来源: 题型:选择题
| A. | 1molNa2CO3约含有6.02×1023个Na2CO3分子 | |
| B. | 2molH2O的摩尔质量为36g/mol | |
| C. | 标准状况下,22.4LCH4含有的电子数为10NA | |
| D. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
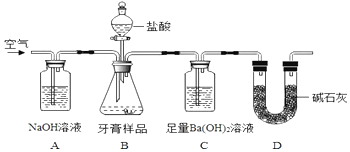 化学兴趣小组对某品牌牙膏中摩擦剂成分及其含量进行以下探究:
化学兴趣小组对某品牌牙膏中摩擦剂成分及其含量进行以下探究:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L H2O含有分子数为NA | |
| B. | 分子总数为NA的N2、CO混合气体体积约为22.4 L,质量为28 g | |
| C. | 4 g金属钙变成钙离子时失去的电子数目为0.1 NA | |
| D. | 常温常压下,1.6 g CH4含原子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两者都能溶于水并且都能和水反应,前者的溶解度大于后者 | |
| B. | 两者都能用于治疗胃酸过多疾病,前者的效果好于后者 | |
| C. | 足量的Na2CO3和NaHCO3分别与等物质的量的稀盐酸反应,前者产生CO2多 | |
| D. | 等体积等浓度的AlCl3溶液分别和足量的Na2CO3和NaHCO3反应,前者产生CO2多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 分类 | 名称(或俗名) | 化学式 | |
| A | 碱性氧化物 | 氧化铁 | FeO |
| B | 碱 | 纯碱 | Na2CO3 |
| C | 盐 | 小苏打 | NaHCO3 |
| D | 酸 | 硫酸 | H2SO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
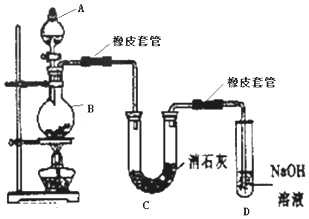
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
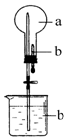 在如图所示的烧瓶中充满干燥气体a,胶头滴管及烧杯中分别盛有液体b.下列a与b的组合中,不可能形成喷泉的是( )
在如图所示的烧瓶中充满干燥气体a,胶头滴管及烧杯中分别盛有液体b.下列a与b的组合中,不可能形成喷泉的是( )| A. | NO2和H2O | B. | SO2和NaOH溶液 | ||
| C. | NH3和H2O | D. | H2、O2混合气体与饱和食盐水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com