
| A. | ②③④⑥ | B. | ②③⑤⑦ | C. | ①③⑤⑥ | D. | ③④⑤⑥ |
分析 ①Mg和浓硫酸、稀硫酸都反应;
②4molH2与1molN2在一定条件下充分反应,该反应中存在化学平衡;
③二氧化锰和浓盐酸在加热条件下反应,和稀盐酸不反应;
④加热条件下,铜和浓硫酸反应,和稀硫酸不反应;
⑤Ag与浓硝酸、稀硝酸都反应;
⑥硫酸和石灰石反应生成微溶物硫酸钙;
⑦Cl2与NaBr发生置换反应,和水反应生成HCl、HClO.
解答 解:①镁和浓硫酸、稀硫酸都反应,所以过量的Mg与浓硫酸反应时,硫酸能完全反应,故不选;
②4molH2与1molN2在一定条件下充分反应,该反应为可逆反应,存在化学平衡,所以反应物不能完全反应,故选;
③在加热条件下,MnO2与浓盐酸反应和稀盐酸不反应,所以即使二氧化锰有剩余,盐酸不能完全反应,故选;
④在加热条件下,Cu与浓硫酸反应和稀硫酸不反应,所以即使铜有剩余,硫酸不能完全反应,故选;
⑤Ag和浓硝酸、稀硝酸都反应,所以Ag过量时硝酸能完全反应,故不选;
⑥硫酸和石灰石反应生成微溶物硫酸钙附着在石灰石表面,从而阻止反应的进一步发生,所以当稀硫酸过量时,生石灰仍然有剩余,故选;
⑦Cl2与NaBr发生置换反应,和水反应生成HCl、HClO,所以氯气过量时NaBr能完全反应,故不选;
故选A.
点评 本题考查物质之间的反应,侧重考查元素化合物知识,明确浓度、反应条件等对化学反应的影响是解本题关键,注意稀硫酸和Cu、稀盐酸和二氧化锰不反应,为易错点.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:选择题
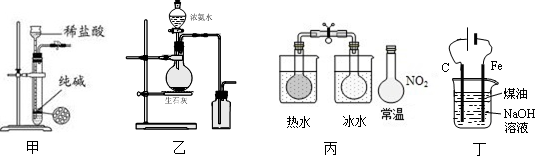
| A. | 用图甲所示装置控制制取少量纯净的CO2气体 | |
| B. | 用图乙所示装置制取并收集氨气 | |
| C. | 用图丙所示装置可以说明反应2NO2(g)?N2O4(g)是放热反应 | |
| D. | 用图丁所示装置可制备Fe(OH)2并能较长时间观察其颜色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 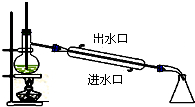 石油的蒸馏 | B. | 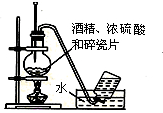 实验室用乙醇制乙烯 | ||
| C. | 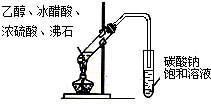 实验室制取乙酸乙酯 | D. | 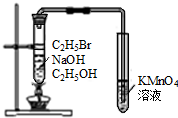 验证溴乙烷发生消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用新制备的Cu(OH)2悬浊液将乙醇、乙酸、葡萄糖、蔗糖几种溶液区别开 | |
| B. | 乙烯与HCl、乙烷与Cl2这两组反应均可得到CH3CH2Cl,但二者反应类型不同 | |
| C. | 分子中有三个甲基且分子式C6H14的烃最多有三种 | |
| D. | 苯能发生加成反应、取代反应但不能发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
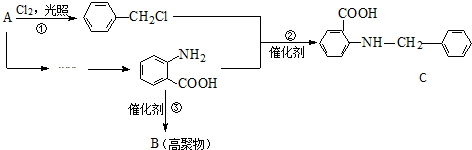
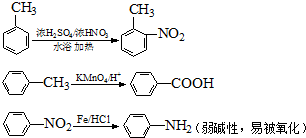
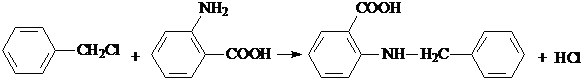 .
.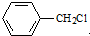 水解产物的同分异构体,且遇氯化铁溶液发生显色反应,写出X所有的可能结构简式:
水解产物的同分异构体,且遇氯化铁溶液发生显色反应,写出X所有的可能结构简式: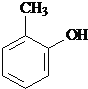 、
、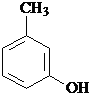 、
、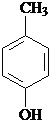 .
.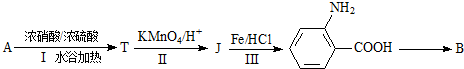
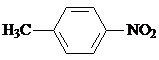 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
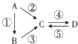 Ⅰ.A、B、C、D均为中学化学常见的纯净物,其中A是单质,它们之间有如图的转化关系.
Ⅰ.A、B、C、D均为中学化学常见的纯净物,其中A是单质,它们之间有如图的转化关系.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某晶体固态不导电,水溶液能导电说明该晶体是离子晶体 | |
| B. | 原子晶体的原子间只存在共价键,而分子晶体内只存在范德华力 | |
| C. | 分子组成相差一个或几个CH2原子团的有机物是同系物 | |
| D. | 在氢原子的基态电子的概率分布图中,小黑点的疏密程度表示电子在该区域空间出现概率的大小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子最外层电子数:X>Y>Z | B. | 对应气态氢化物的稳定性:X>Z | ||
| C. | 离子半径:X2->Y+>Z- | D. | 原子序数:X>Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5.+3.-3 | -2 |
| A. | X.Y元素的金属性:X<Y | |
| B. | Z的最高价含氧酸分子式为H3ZO4 | |
| C. | Y的最高价氧化物对应的水化物能溶于氢氧化钠溶液 | |
| D. | Z的氢化物比W的氢化物稳定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com