
| A. | 高纯度二氧化硅广泛用于制作光导纤维,其遇强碱会“断路” | |
| B. | 家用“84”消毒液可用来漂白衣物,为了增强漂白效果,可加入浓盐酸 | |
| C. | 浸泡过高锰酸钾溶液的硅藻土可以吸收乙烯,所以可用来保鲜水果 | |
| D. | 加热能杀死甲型 H1N1流感病毒是因为蛋白质受热变性 |
分析 A.根据光导纤维的主要成分是二氧化硅以及二氧化硅能与氢氧化钠溶液反应,生成硅酸钠和水;
B.加入浓盐酸,发生氧化还原反应生成氯气,减小HClO的浓度;
C.乙烯较活泼,能被强氧化剂高锰酸钾氧化;
D.加热能使蛋白质变性.
解答 解:A.二氧化硅能用于制光导纤维、二氧化硅能与氢氧化钠溶液反应,生成硅酸钠和水,所以光导纤维遇强碱会“断路”,故A正确;
B.加入浓盐酸,发生氧化还原反应生成氯气,减小HClO的浓度,则减弱84消毒液的漂白效果,故B错误;
C.乙烯具有催熟作用,为了延长水果的保鲜期,用高锰酸钾可以除掉乙烯,故C正确;
D.病毒的成分是蛋白质,加热能使蛋白质变性,故D正确;
故选B.
点评 本题主要考查了生活的化学相关的知识,侧重考查学生元素以及化合物的性质和应用知识,属于综合知识的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
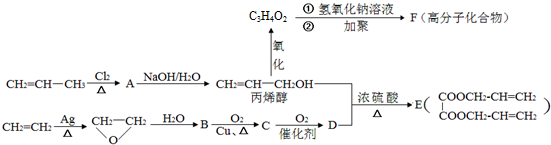
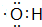 ;丙烯→A的反应类型为取代反应.
;丙烯→A的反应类型为取代反应.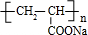 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
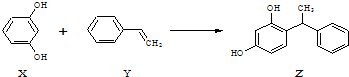
| A. | X、Z均能与Na2CO3溶液反应 | |
| B. | X可作缩聚反应单体,Y可作加聚反应单体 | |
| C. | X、Y、Z均能使溴水褪色,但是原理不相同 | |
| D. | 该反应的反应类型为取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
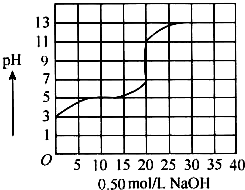 在100mL盐酸的溶液中,以0.50mol/L氢氧化钠溶液滴定后得滴定曲线如图所示,下列叙述正确的是( )
在100mL盐酸的溶液中,以0.50mol/L氢氧化钠溶液滴定后得滴定曲线如图所示,下列叙述正确的是( )| A. | 盐酸在滴定前的浓度是0.3mol/L | |
| B. | 该盐酸稀释10倍后pH为4 | |
| C. | 滴定过程为求滴定终点,指示剂只能用酚酞 | |
| D. | 若用酚酞作指示剂,滴定终点时溶液颜色的变化为红色到无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaHSO3溶液中通入NH3至中性,溶液中存在:c(NH4+)>c(SO32-) | |
| B. | NH4Cl和NH3•H2O混合液pH=7,一定存在c(NH4+)=c(Cl-) | |
| C. | NaHCO3溶液中存在HCO3-+H2O?H3O++CO32-,加水稀释后c(H+)减小 | |
| D. | pH相同的氯化铵与硫酸亚铁铵两种溶液中铵根离子浓度前者大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
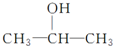 的四种有机物的1H核磁共振谱(1H-NMR).其中属于CH3CH2CH2OH的1H-NMR谱图的是( )
的四种有机物的1H核磁共振谱(1H-NMR).其中属于CH3CH2CH2OH的1H-NMR谱图的是( )| A. |  | B. | 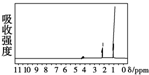 | C. | 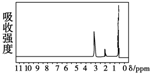 | D. | 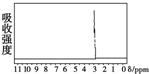 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
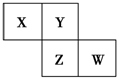 X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层是内层电子数的3倍,下列说法正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层是内层电子数的3倍,下列说法正确的是( )| A. | X的简单气态氢化物的稳定性比Y的强 | |
| B. | W的氧化物对应水化物的酸性比Z的强 | |
| C. | ZY2的水溶液具有酸性、氧化性、还原性 | |
| D. | Z和钠形成的化合物Na2Z2中只有离子键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com