
【题目】下列各组化合物中化学键类型不同的是( )
A.![]() 和
和![]()
B.NaCl和HCl
C.CaO和KCl
D.![]() 和
和![]()
【答案】B
【解析】
A.H2O为H原子与O原子通过共用电子对形成的共价化合物,只含有共价键,而NH3为N原子与H原子通过共用电子对形成的共价化合物,只含有共价键,二者均只含有共价键,化学键类型相同,故A不符合题意;
B.NaCl为Na+与Cl-形成的离子化合物且只含有离子键,而HCl为H原子与Cl原子通过共用电子对形成的共价化合物,只含有共价键,二者化学键类型不同,故B符合题意;
C.CaO为Ca2+与O2-形成的离子化合物且只含有离子键,而KCl为K+与Cl-形成的离子化合物且只含有离子键,二者均只含有离子键,化学键类型相同,故C不符合题意;
D.CCl4为C原子与Cl原子通过共用电子对形成的共价化合物,只含有共价键,而H2O2为H原子与O原子、O原子与O原子通过共用电子对形成的共价化合物,只含有共价键,二者均只含有共价键,化学键类型相同,故D不符合题意;
答案为B。


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:
【题目】烃是一类简单的有机化合物。
(1)天然气属于______________(填“纯净物”或“混合物”),其组成以__________为主。该分子的电子式是_____________,其空间结构是_____________________。
(2)烷烃随着碳原子数的增多,沸点逐渐________(填“升高”或“降低”),碳原子数≤________的烷烃呈气态,它们和氯气发生取代反应的条件是________________。
(3)2,2,3-三甲基丁烷的结构简式是____________________________________,其一氯代物有_______种,该烷烃与正庚烷互为__________________________(填“同系物”或“同分异构体”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某CuSO4、Fe2(SO4)3、H2SO4的混合溶液100 mL,已知溶液中阳离子的浓度相同,且SO42-物质的量浓度为6 mol/L,则此溶液最多溶解铁粉的质量为( )
A.11.2 gB.16.8 gC.19.6 gD.22.4 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯胺(![]() )是重要的化工原料。某兴趣小组在实验室里制取并纯化苯胺。
)是重要的化工原料。某兴趣小组在实验室里制取并纯化苯胺。
已知:①![]() 与NH3相似,与盐酸反应生成
与NH3相似,与盐酸反应生成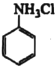 (易溶于水的盐)。
(易溶于水的盐)。
②用硝基苯制取苯胺的反应为:2![]() +3Sn+12HCl
+3Sn+12HCl![]() 2
2![]() +3SnCl4+4H2O
+3SnCl4+4H2O
③有关物质的部分物理性质见下表:
物质 | 相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 | 密度/g·cm-3 |
苯胺 | 93 | 6.3 | 184 | 微溶于水,易溶于乙醚 | 1.02 |
硝基苯 | 123 | 5.7 | 210.9 | 难溶于水,易溶于乙醚 | 1.23 |
乙醚 | 74 | 116.2 | 34.6 | 微溶于水 | 0.7134 |
Ⅰ.制备苯胺
图1所示装置中加入20mL浓盐酸(过量),置于热水浴中回流20min,使硝基苯充分还原;冷却后,向三颈烧瓶中滴入一定量50%NaOH溶液,至溶液呈碱性。
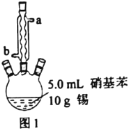
(1)滴加适量NaOH溶液的目的是___,写出主要反应的离子方程式___。
ⅰ.取出图l所示装置中的三颈烧瓶,改装为图2所示装置。加热装置A产生水蒸气。用“水蒸气蒸馏”的方法把B中苯胺逐渐吹出,在烧瓶C中收集到苯胺与水的混合物;分离混合物得到粗苯胺和水溶液甲。
ⅱ.向所得水溶液甲中加入氯化钠固体至饱和,再用乙醚萃取,得到乙醚萃取液。
iii.合并粗苯胺和乙醚萃取液,用NaOH固体干燥,蒸馏后得到苯胺1.86g。
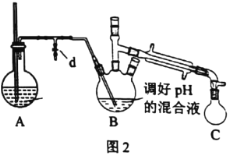
(2)装置A中玻璃管的作用是__。
(3)在苯胺吹出完毕后,应进行的操作是先__,再___。
(4)该实验中苯胺的产率为___(保留三位有效数字)。
(5)欲在不加热条件下除去苯胺中少量的硝基苯杂质,简述实验方案___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见的五种盐X、Y、Z、M、N,它们的阴离子可能是SO42-、Cl-、NO3-、CO32-,阳离子可能是Ag+、NH4+、Na+、Al3+、Cu2+、Ba2+、Fe3+,已知:①M的焰色反应呈黄色。②五种盐均能溶于水,水溶液均为无色。③X的溶液呈中性,Y、Z、N的溶液呈酸性,M的溶液呈碱性。④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有X、Z的溶液不产生沉淀。⑤若在这五种盐的溶液中,分别加入氨水,N和Z的溶液中生成沉淀,继续加氨水,Z中沉淀消失。⑥把X的溶液分别加入到Y、Z、N的溶液中,均能生成不溶于稀硝酸的沉淀。请回答下列问题:
(1)五种盐中,所含阴离子相同的两种盐的化学式是______________。
(2)M溶液显碱性的原因是(用离子方程式表示)_______________________。
(3)X和Z的溶液反应的离子方程式是______________________________。
(4)N和氨水反应的离子方程式是_____________________________________。
(5)若要检验Y中所含的阳离子,正确的实验方法是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
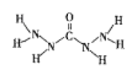
【题目】下列变化①碘的升华②烧碱熔化③氯化钠溶于水④氯化氢溶于水⑤氧气溶于水⑥氯化铵受热分解。
氯化铵的电子式是______________;未发生化学键破坏的是______________(填序号,下同);仅发生离子键破坏的是______________;仅发生共价键破坏的是______________;既发生离子键又发生共价键破坏的是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A是近年来采用的锅炉水添加剂,其结构式如图,A能除去锅炉水中溶解的氧气,下列说法正确的是( )
A. A分子中所有原子都在同一平面内
B. A分子中所含的σ键与π键个数之比为10:1
C. 所含C、N均为sp2杂化
D. A与O2反应生成CO2、N2、H2O的物质的量之比为1:2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛是一种性能非常优越的金属,21世纪将是钛的世纪。
(1)TiO2薄膜中掺杂铬能显著提高光催化活性。基态Cr原子的核外电子排布式为____。
(2)四乙醇钛能增加橡胶在金属表面的粘附性。其制备原理如下:TiCl4+4CH3CH2OH+4NH3=Ti(OCH2CH3)4+4NH4Cl
①Ti(OCH2CH3)4可溶于有机溶剂,常温下为淡黄色透明液体,其晶体类型为____
②N和O位于同一周期,O的第二电离能大于N的第二电离能的原因是_____;
③NH4Cl中存在的作用力有_____,NH4Cl熔沸点高于CH3CH2OH的原因是_____,Ti(OCH2CH3)4分子中C原子的杂化形式均为 ____。
(3)钛酸锶(SrTiO3)可作电子陶瓷材料和人造宝石,其中一种晶胞结构如图所示。若Ti位于顶点位置,O位于____位置;已知晶胞参数为a nm,Ti位于O所形成的正八面体的体心,则该八面体的边长为_____ m(列出表达式)。
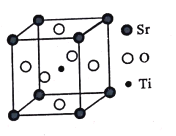
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物甲由四种元素组成。某化学研究小组按如图流程探究其组成:

已知丙和丁是相对分子质量相同的常见气体,其中丁是空气的主要成分之一。请回答下列问题:
(1)甲的化学式为____。
(2)甲发生爆炸反应的化学方程式为____。
(3)已知化合物甲中,有两种元素的化合价为最高正价,另两种元素的化合价为最低负价,则爆炸反应中被氧化的元素与还原产物的物质的量之比为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com