
| T | ||
| X | Y | Z |
短周期元素R、T、X、Y、Z在元素周期表的相对位置如下表所示,它们的最外层电子数之和为24。则下列判断正确的是( )
A.R位于元素周期表中第二周期第VA族
B.R能分别与X、Z形成共价化合物
C.气态氢化物稳定性:Y>T
D.Z元素的最高价氧化物对应的水化物的化学式为HZO4
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
某消毒液的主要成分为NaClO,还含有一定量的NaOH,下列用来解释事实的方程式中不合理的是(已
知:饱和NaClO溶液的pH约为11)
A.该消毒液可用NaOH溶液吸收Cl2制备:Cl2 +2OH-=== Cl-+ ClO-+ H2O
B.该消毒液的pH 约为12:ClO-+ H2O
约为12:ClO-+ H2O
 HClO+ OH-
HClO+ OH-
C.该消毒液与洁厕灵(主要成分为HCl)混用,产生Cl2:2H++ Cl-+ ClO-= Cl2 ↑+ H2O
D.该消毒液加白醋生成HClO,可增强漂白作用:CH3COOH+ ClO-= HClO+ CH3COO—
查看答案和解析>>
科目:高中化学 来源: 题型:
对于可逆反应H2(g)+I2(g)2HI(g),在温度一定下由H2(g)和I2(g)开始反应,下列说法正确的是( )
A.H2(g)的消耗速率与HI(g)的生成速率比为21
B.反应进行的净速率是正、逆反应速率之差
C.正、逆反应速率的比值是恒定的
D.达到平衡时,正、逆反应速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应
X(g)+Y(g)  2Z(g) △H< 0,一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g) △H< 0,一段时间后达到平衡,反应过程中测定的数据如下表:
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是
A.0~2min的平均速率ν(Z) = 2.0×10-3mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前ν(逆)>ν(正)
C.该温度下此反应的平衡常数K =1.44
D. 其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
在常温下,对于pH=3的醋酸溶液。下列说法正确的是( )。
A.在醋酸溶液中,NH4+、Na、SiO32、C2O42能大量共存
B.与Na2S2O3溶液反应的离子方程式:S2O32+2H=S↓+SO2↑+H2O
C.常温下,加水稀释醋酸,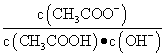 增大
增大
D.该醋酸溶液中c(CH3COO)<0.001 mol•L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
下表中的陈述均正确并且前后存在因果关系的是( )
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | SO2有漂白性 | SO2可使溴水和酸性高锰酸钾溶液褪色 |
| B | Fe3+有强氧化性 | FeCl3溶液可用于回收废旧电路板中的铜 |
| C | 浓硫酸有吸水性 | 浓硫酸可使蔗糖和纸张碳化变黑 |
| D | SiO2有导电性 | SiO2可用于制备光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:
磺酰氯(SO2Cl2)和亚硫酰氯(SOCl2)均是实验室常见试剂。
已知: SO2Cl2(g) SO2(g) + Cl2(g) K1 △H=a kJ/mol (Ⅰ)
SO2(g) + Cl2(g) K1 △H=a kJ/mol (Ⅰ)
SO₂(g) +Cl₂(g)+ SCl₂(g) 2SOCl₂(g) K2 △H=b kJ/mol (Ⅱ)
2SOCl₂(g) K2 △H=b kJ/mol (Ⅱ)
(1)反应:SO2Cl2(g)+ SCl₂(g)  2SOCl2(g)的平衡常数K = (用K1、K2表示),该反应
2SOCl2(g)的平衡常数K = (用K1、K2表示),该反应
△H= kJ/mol(用a、b表示)。
(2)为研究不同条件对反应(Ⅰ)的影响,以13.5 g SO2Cl2充入2.0L的烧瓶中,在101kPa 375K时,10min达到平衡,平衡时SO2Cl2转化率为0.80,则0~10minCl2的平衡反应速率为 ,平衡时容器内压强为 kPa,该温度的平衡常数为 ;若要减小SO2Cl2转化率,除改变温度外,还可采取的措施是 (列举一种)。
(3)磺酰氯对眼和上呼吸道粘膜有强烈的刺激性,发生泄漏时,实验室可用足量NaOH固体吸收,发生反应的化学方程式为 ;亚硫酰氯溶于水的离子方程式为 。
(4)一定量的Cl2用稀NaOH溶液吸收,若恰好反应,则溶液中各离子浓度由大到小的顺序为 ;
已知常温时次氯酸的Ka=2.5×10-8则该温度下NaClO水解反应的平衡常数
Kb= mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
下述实验能达到预期目的的是( )
| 选项 | 实验内容 | 实验目的 |
| A | 向1 mL 0.2 mol·L-1 NaOH溶液中滴入2滴0.1 mol·L-1 MgCl2溶液,产生白色沉淀后,再滴加2滴0.1 mol·L-1 FeCl3溶液,又生成红褐色沉淀 | 证明在相同条件下,溶解度Mg(OH)2>Fe(OH)3 |
| B | 向混有BaCO3沉淀的NaOH溶液中滴入已知浓度的盐酸(用酚酞作指示剂) | 滴定其中NaOH含量 |
| C | 两种一元碱溶液X和Y(X的pH比Y大1),分别加水稀释100倍后,pH相等 | 证明稀释前c(X)=10c(Y) |
| D | 测定等物质的量浓度的HF与HCl溶液的pH,后者较小 | 证明非金属性Cl>F |
查看答案和解析>>
科目:高中化学 来源: 题型:
0.1 mol某金属单质与足量的盐酸反应,放出1.12LH2(标准状况),并转变为具有Ar原子的电子层结构的离子,该金属元素在元素周期表中的位置是
A.第三周期第IA族 B.第四周期第IA族
C.第三周期第ⅡA族 D.第四周期第ⅡA族
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com