
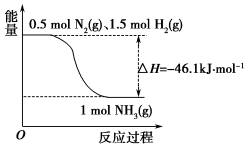
 氨在工农业生产中应用广泛.
氨在工农业生产中应用广泛.分析 (1)结合图象曲线变化可知,反应1molN2和1.5molH2具有的能量大于1molNH3,该反应为吸放热反应,根据热化学方程式的书写原则进行解答;
(2)N2 和H2反应生成2mol NH3时放出的热量为92.2kJ,是指1mol氮气和3mol的氢气完全反应生成2mol的氨气放出的热量为92.2kJ,1mol N2 和3mol H2 放在密闭容器中不可能完全转化为氨气,由此分析解答;催化剂改变反应速率不改变化学平衡;
(3)依据热化学方程式的意义和盖斯定律的内容通过合并计算得到热化学方程式.
解答 解:(1)根据图象可知,反应1molN2和1.5molH2具有的能量大于1molNH3,该反应为放热反应,焓变为负值,则生成2molNH3,放热46.1KJ×2=92.2KJ,则该反应的热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ/mol,
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ/mol;
(2)N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ/mol,N2 和H2反应生成2mol NH3时放出的热量为92.2kJ,是指1mol氮气和3mol的氢气完全反应生成2mol的氨气放出的热量为92.2kJ,1mol N2 和3mol H2 放在密闭容器中不可能完全转化为氨气,所以放出热量一定小于92.2 kJ,催化剂改变反应速率不改变化学平衡,反应热不变,
故答案为:小于;该反应是可逆反应,反应物无法全部转化为生成物;不变;
(3)①N2(g)+O2(g)=2NO2(g)△H1=+67.7kJ/mol
②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H2=-534kJ/mol
依据盖斯定律:②×2-①得到:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7KJ/mol,则1mol N2H4与NO2完全反应的热化学方程式为N2H4(g)+NO2(g)=$\frac{3}{2}$N2(g)+2H2O(g)△H=-567.85 kJ•mol-1,
故答案为:N2H4(g)+NO2(g)=$\frac{3}{2}$N2(g)+2H2O(g)△H=-567.85 kJ•mol-1.
点评 本题考查了热化学方程式的书写方法和盖斯定律的计算应用,明确反应热与焓变的关系为解答关键,注意掌握热化学方程式的书写原则,试题侧重基础知识的考查,有利于提高学生的灵活应用能力,注意反应的可逆性,可逆反应永远是反应物和生成物共存的体系,题目难度中等.


 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:多选题
| A. | 原子序数116 | B. | 中子数177 | C. | 核外电子数116 | D. | 质子数177 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
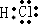 ,X2Y的结构式
,X2Y的结构式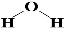 .
.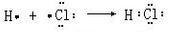 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+、Zn2+、Cr3+、Fe3+ | B. | Cr3+、Fe3+、Zn2+、Mg2+ | ||
| C. | Fe3+、Cr3+、Zn2+、Mg2+ | D. | Zn2+、Mg2+、Cr3+、Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
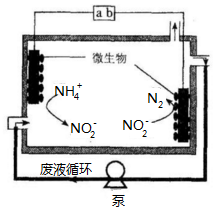 微生物电解法可用于处理废水.其工作原理如图所示,下列说法正确的是( )
微生物电解法可用于处理废水.其工作原理如图所示,下列说法正确的是( )| A. | a为电源的负极 | |
| B. | 右侧电极反应式为:2NO2-+6e-+4 H+=N2↑+4OH- | |
| C. | 电池工作一段时间后,溶液中NO2-的浓度不变 | |
| D. | 每通过3mol电子,最多处理0.5mol NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 偏二甲肼(C2H8N2)的摩尔质量为60g | |
| B. | 火箭发射时,偏二甲肼(C2H8N2)燃烧生成CO2、N2、H2O | |
| C. | 偏二甲肼(C2H8N2)中所有原子最外层都达到8个电子 | |
| D. | 从能量变化看,主要是化学能转变为热能和动能,它是一种能量很高的烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| NaCl浓度(g.L-1) 温度(℃) | 20 | 40 | 60 | 100 | 180 | 260 | 300 |
| 13 | 3 | 1 | 0 | 0 | 3 | 9 | 13 |
| 50 | 8 | 4 | 3 | 5 | 10 | 21 | 35 |
| 100 | 17 | 11 | 12 | 15 | 30 | 65 | 95 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com