
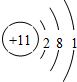
 ;Na在氧气中燃烧生成过氧化钠,为离子化合物,其电子式为
;Na在氧气中燃烧生成过氧化钠,为离子化合物,其电子式为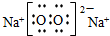 ;
; ;
;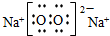 ;
;

科目:高中化学 来源: 题型:
| A、25℃时,pH=13的1.0L Ba(OH)2溶液中含有的OH-数目为0.2NA |
| B、1 mol OH-在电解过程中完全放电时电路中通过了NA个电子 |
| C、铜的电解精炼时,阳极上每转移2mol电子时就溶解铜原子NA个 |
| D、1mol/L的Na2CO3溶液中CO32-粒子数目小于NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
 肼(N2H4)广泛用于火箭推进剂、有机合成及电池燃料.请回答下列问题:
肼(N2H4)广泛用于火箭推进剂、有机合成及电池燃料.请回答下列问题:| 实验Ⅰ:催化剂用量与配比对催化 活性影响 |
实验Ⅱ:水合肼用量对反应时间的影响 | 实验Ⅲ:反应温度对反应时间的影响 | ||||||||
| 序号 | m(Fe3+) /g |
m(Al3+) /g |
100%转化 消耗时间/min |
序号 | n(对氯硝基苯):n(水合肼) | 反应时间/min | 序号 | 反应温度/℃ | 反应时间/min | 转化率% |
| ① | 5 | 5 | 70 | ① | 1:1.5 | 110 | ① | 78 | 70 | 89 |
| ② | 10 | 不加 | 110 | ② | 1:1.8 | 110 | ② | 75 | 60 | 91 |
| ③ | 10 | 0.8 | 60 | ③ | 1:2.0 | 40 | ③ | 70 | 40 | 100 |
| ④ | 10 | 1 | 40 | ④ | 1:2.2 | 30 | ④ | 65 | 110 | 95 |
| ⑤ | 20 | 1 | 70 | / | / | / | ⑤ | 60 | 110 | 88 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 室温下,向20mL a mol?L-1 CH3COOH溶液中逐滴加入0.1mol?L-1 NaOH溶液,其pH变化曲线如图所示.下列说法中,正确的是( )
室温下,向20mL a mol?L-1 CH3COOH溶液中逐滴加入0.1mol?L-1 NaOH溶液,其pH变化曲线如图所示.下列说法中,正确的是( )| A、a=1×10-3 |
| B、V(NaOH)=200amL时,溶液中:c (Na+)=c(CH3COO-)+c(CH3COOH)=0.1mol?L-1 |
| C、该滴定实验使用甲基橙作指示剂 |
| D、d点之后的溶液中离子浓度大小关系可能满足:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com