
| A、CO2 |
| B、Cl2 |
| C、H2O |
| D、PF3 |


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
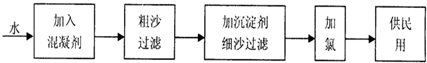
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | I1 | I2 | I3 | I4 |
| X | 502 | 4 600 | 6 900 | 9 500 |
| Y | 588 | 1 820 | 2 750 | 11 600 |
| A、元素X的常见化合价是+1 |
| B、若元素Y处于第3周期,它可与冷水剧烈反应 |
| C、元素Y是ⅢA族元素 |
| D、元素X与氯形成化合物时,化学式可能是XCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
 钙、铝、铜都是中学化学中常见的金属元素.
钙、铝、铜都是中学化学中常见的金属元素.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g |
| B、在熔融状态下,lmol NaHSO4完全电离出的阳离子数为2NA |
| C、5.6 g铁粉在2.24L(标准状况)氯气中充分燃烧,失去的电子数为0.3NA |
| D、78g Na2O2固体与H2O完全反应转移的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
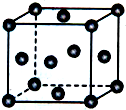 已知X、Y、Z为短周期元素,X、Y同周期,X和Z同主族,Y原子基态时2p轨道上的未成对电子数最多,X的低价氧化物和Y单质分子的电子数相等.W2+的核外电子排布简式为[Ar]3d9.
已知X、Y、Z为短周期元素,X、Y同周期,X和Z同主族,Y原子基态时2p轨道上的未成对电子数最多,X的低价氧化物和Y单质分子的电子数相等.W2+的核外电子排布简式为[Ar]3d9.查看答案和解析>>
科目:高中化学 来源: 题型:
| SO | 2- 4 |
| O | - 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com