
 人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.
人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
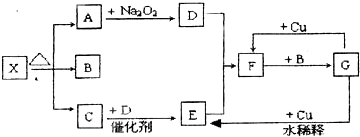
 实验室通过加热氯化铵和消石灰来制取氨气.
实验室通过加热氯化铵和消石灰来制取氨气.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,17.6g丙烷中所含的极性共价键为4NA |
| B、常温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA |
| C、28g聚乙烯树脂完全燃烧时,转移的电子数目为3NA |
| D、在合成28g聚乙烯树脂的单体中,含有的双键数目为1.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na和Cl | B、K和F |
| C、Na和F | D、Ca和Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ① | ② | ③ | 实验结论 |  | |
| A | 饱和食盐水 | 电石 | 溴水 | 乙炔和溴水发生加成反应 | |
| B | 浓盐酸 | KMnO4 | FeCl2溶液 | 氧化性:MnO4->Cl2>Fe3+ | |
| C | 浓氨水 | 生石灰 | AlCl3溶液 | Al(OH)3具有两性 | |
| D | 稀盐酸 | Na2CO3 | Na2SiO3溶液 | 非金属性:Cl>C>Si |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
 国家实验室一个研小组发现首例带结晶水的晶体在 5K 下呈现超导性.据报道,该晶体中含有最简式为 CoO2 的层状结构,结构如右图(小球表示Co原子,大球表示O原子).下列用粗线画出的CoO2层状结构的晶胞(晶胞是在晶体中具有代表性的最小重复单元)示意图不符合化学式的是( )
国家实验室一个研小组发现首例带结晶水的晶体在 5K 下呈现超导性.据报道,该晶体中含有最简式为 CoO2 的层状结构,结构如右图(小球表示Co原子,大球表示O原子).下列用粗线画出的CoO2层状结构的晶胞(晶胞是在晶体中具有代表性的最小重复单元)示意图不符合化学式的是( )A、 |
B、 |
C、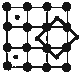 |
D、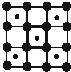 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com