
����Ŀ��A��B��C��D��E���ֶ�����Ԫ�ص�ԭ������������������Ԫ����ֻ��һ�ֽ���Ԫ�ء�A��Bͬ���ڣ�������AB2��DB2���ǿ�ʹ����ʯ��ˮ����ǵ����塣����֪C��E�ĵ��ʾ�������NaOH��Һ����C��NaOH��Һ��Ӧ�ɲ������塣
��1��A��EԪ�ص�Ԫ�ط��ţ�A __________��E ____________
��2��AB2�ĵ���ʽΪ____________________
��3��DB2ʹ����ʯ��ˮ����ǵĻ�ѧ����ʽ��__________________________________
��4��E�ĵ�����NaOH��Һ��Ӧ�����ӷ���ʽ�� ________________________________________
���𰸡� C Cl ![]() SO2+Ca(OH)2��CaSO3��+H2O Cl2+2OH����Cl��+ClO��+H2O
SO2+Ca(OH)2��CaSO3��+H2O Cl2+2OH����Cl��+ClO��+H2O
��������A��B��C��D��E���ֶ�����Ԫ�ص�ԭ������������������Ԫ����ֻ��һ�ֽ���Ԫ�ء�A��Bͬ���ڣ�������AB2��DB2���ǿ�ʹ����ʯ��ˮ����ǵ����壬������CO2��SO2�����A��C��B��O��D��S������֪C��E�ĵ��ʾ�������NaOH��Һ����C��NaOH��Һ��Ӧ�ɲ������壬����C��Al��E��Cl���ݴ˽��
�������Ϸ�����֪A��C��B��O��C��Al��D��S��E��Cl����
��1��A��EԪ�ص�Ԫ�ط��ŷֱ���C��Cl��
��2��AB2�Ƕ�����̼�����й��ۼ�������ʽΪ![]() ��
��
��3��SO2ʹ����ʯ��ˮ����ǵĻ�ѧ����ʽΪSO2+Ca(OH)2��CaSO3��+H2O��
��4��������NaOH��Һ��Ӧ�����ӷ���ʽΪCl2+2OH����Cl��+ClO��+H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ�ص��������ʣ�����ԭ�������ĵ������������Ա仯����(����)
A.���ϼ�B.ԭ�Ӱ뾶
C.Ԫ�ص�ʧ�����Ժ͵õ�����D.���ԭ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Һ����Ũ�Ⱦ�Ϊ0.01molL��1��Fe3+��Cr3+��Zn2+��Mg2+�����ӣ���֪��25��ʱ��Ksp[Fe��OH��3]=4.0��10��38��Ksp[Cr��OH��3]=7.0��10��31 �� Ksp[Zn��OH��2]=1.0��10��17��Ksp[Mg��OH��2]=1.8��10��11 �� ������������տ�ʼ����ʱ��������һ�����������pH��С��������
A.Fe3+
B.Cr3+
C.Zn2+
D.Mg2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��ѧ��ӦA2��g��+B2��g��=2AB��s���������仯��ͼ��ʾ������������ȷ���ǣ������� 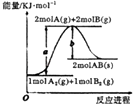
A.�÷�ӦΪ���ȷ�Ӧ
B.�Ӵ����ܽ��÷�Ӧ�ʱ�
C.A��B�ļ���ΪbkJmol��1
D.�÷�Ӧ�ķ�Ӧ��Ϊ��H=��a��b��kJmol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2017���ҹ��н�ȫ��������ɿ���2500�����ҵ��������δ��������Դ�Ŀ���������Ҫս�Լ�ֵ��������зḻ���̽�˿�(��Ҫ�ɷ�ΪMnO2��������Fe��Al������Ԫ��)�������̽�˿�����Ʊ��ߴ�̼���̣���ش������й�����:
��1��д����MnO2��Ũ������ȡ�����Ļ�ѧ����ʽ________________��
��2��MnO2���������ķ�Ӧʮ�ָ��ӡ������������£�MnO2���Ա�H2O2��ԭ��Mn2+����H2O2���������ԣ����о�������H2O2��Һ����������HO2-���¡�����������ͬʱ���о���ͬ��ʼpH������H2O2��Һ��Ư��Ч���������ͼ��ʾ:
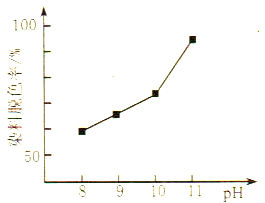
��д��MnO2��������������H2O2��Ӧ�����ӷ���ʽ____________��
����ͼ�ɵõ��Ľ�����_________�����ƽ���ƶ�ԭ����������:__________��
��3�������̽�˿���ʵ�����Ʊ��ߴ�̼���̵��������£�
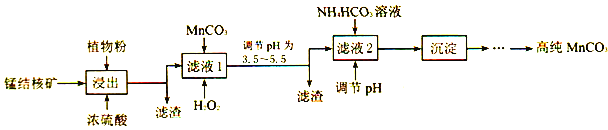
������SO2����ֲ��ۣ�ֲ��۵�������___________��
��ʹ��̼���̵�pH��������___________��
������NH4HCO3ʱ���¶�Ҫ������35�����£���Ŀ����___________��
��4���ڷ�ˮ�����г���H2S��Mn2+ת��ΪMnS��ȥ������0.020mo/LMn2+�ķ�ˮ��ͨ��һ������H2S���壬������Һ��pH����c(HS-)=1.0��10-4mol/Lʱ��Mn2+��ʼ���������ʱ��Һ��pH=______��[��֪:Ksp(MnS)=1.4��10-15��H2S�ĵ��볣��K1=1.3��10-7��K2=7.0��10-15]
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ������з�����Ӧ��X+2Y2Z����H��0��������Z����̬����Z��ƽ�������е����������Z%�����¶ȣ�T����ѹǿ��P���Ĺ�ϵ��ͼ�������ж���ȷ���ǣ������� 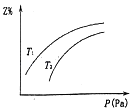
A.Yһ������̬
B.T1����T2
C.�����¶ȣ��÷�Ӧ�Ļ�ѧƽ�ⳣ������
D.��c��X����c��Y����c��Z��=1��2��2ʱ����Ӧ�ﵽƽ��״̬
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ̼����(����ԼΪ98��)�к���Mg2����Fe2����Cl����SO42�������ʣ��ᴿ�����������£�
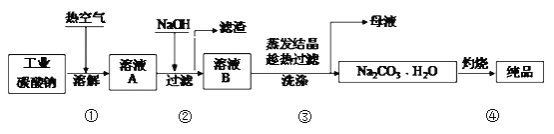
����˵������ȷ����
A. ����٣�ͨ���ȿ����ɼӿ��ܽ�����
B. ����ڣ��������������ӷ�ӦΪ��Mg2+ + Fe3+ + 5OH- == Mg(OH)2��+ Fe(OH)3��
C. ����ۣ����ȹ���ʱ�¶ȿ��Ʋ�����ʹNa2CO3H2O�л���Na2CO310H2O������
D. ����ܣ�����ʱ�õ�����Ҫ�������������������ǡ����żܡ��ƾ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�У������ȷ�Ӧ���ǣ� ��
A.��Ƭ��ϡ���ᷴӦB.�Ҵ��ڿ�����ȼ��
C.����������������Һ��ӦD.Ba(OH)28H2O�������Ȼ�茶��巴Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CH3��CH===CH��Cl�����з�Ӧ������ ȡ����Ӧ���� �ӳɷ�Ӧ���� ��ȥ��Ӧ���� ʹ��ˮ��ɫ���� ʹ����KMnO4��Һ��ɫ���� ��AgNO3��Һ���ɰ�ɫ�������� �ۺϷ�Ӧ�����ڸ��л���
A. ���Ϸ�Ӧ���ɷ��� B. ֻ�Т߲��ܷ���
C. ֻ�Т��ܷ��� D. ֻ�Тڲ��ܷ���
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com