
在稀硫酸中加入铜粉,铜粉不溶,再加入下列物质:①FeCl3;②Fe2O3;③Cu(NO3)2;④KNO3,铜粉溶解的是( )
A.只有①或② B.只有①或②或④
C.只有①或②或③ D.上述任意一种
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源:2014高考化学二轮专题突破 专题二化学用语及常用计量练习卷(解析版) 题型:填空题
(Ⅰ)在室温下,向某一容积固定的真空容器内充入丁烷(气)和氧气,使容器内混合气的总压强达到p1,点火燃烧,氧气反应完全,冷却至室温后容器内气体的总压强为p2。
(1)若丁烷燃烧的生成物只有H2O(液)和CO2,则p2/p1= 。
(2)若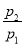 =0.64,则反应前混合气中丁烷的物质的量分数= 。
=0.64,则反应前混合气中丁烷的物质的量分数= 。
(Ⅱ)设阿伏加德罗常数为NA,在常温常压下气体的摩尔体积为Vm L·mol-1,O2和N2的混合气体a g含有b个分子,则c g该混合气体在常温常压下所占的体积应是 L。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题七化学反应与能量练习卷(解析版) 题型:选择题
下列各组热化学方程式中,Q1<Q2的是( )
A.CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-Q1 kJ·mol-1
CH4(g)+3/2O2(g)=CO(g)+2H2O(g) ΔH=-Q2 kJ·mol-1
B.S(g)+O2(g)=SO2(g) ΔH=-Q1 kJ·mol-1
S(s)+O2(g)=SO2(g) ΔH=-Q2 kJ·mol-1
C.H2(g)+Br2(g)=2HBr(g) ΔH=-Q1 kJ·mol-1
H2(g)+Cl2(g)=2HCl(g) ΔH=-Q2 kJ·mol-1
D.HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l) ΔH=-Q1 kJ·mol-1
CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) ΔH=-Q2 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题一物质的组成性质和分类练习卷(解析版) 题型:选择题
《美国化学会志》报道:中国科学家以二氧化碳为碳源、金属钠为还原剂,在470 ℃,80 MPa条件下合成出金刚石,具有深远意义。下列说法不正确的是( )
A.由二氧化碳合成金刚石是化学变化
B.此反应中金刚石是氧化产物
C.金刚石是碳单质的一种同素异形体
D.此反应中钠元素发生氧化反应
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题9金属及其化合物练习卷(解析版) 题型:填空题
为探索工业含铝、铁、铜合金废料的再利用,甲同学设计的实验方案如下:

请回答:
(1)操作①用到的玻璃仪器有 。
(2)写出反应①的化学方程式: ,反应②的离子反应方程式: 。
(3)设计实验方案,检测滤液D中含有的金属离子(试剂自选) 。
(4)在滤渣E中加入稀硫酸和试剂Y制胆矾晶体是一种绿色化学工艺,试剂Y为无色液体,反应④的总化学方程式是 。
(5)乙同学在甲同学方案的基础上提出用滤渣B来制备FeCl3·6H2O晶体,在滤渣中滴加盐酸时,发现反应速率比同浓度盐酸与纯铁粉反应要快,其原因是 。
将所得氯化铁溶液用加热浓缩、降温结晶法制得FeCl3·6H2O 晶体,而不用直接蒸发结晶的方法来制得晶体的理由是 。
(6)将滤渣B的均匀混合物平均分成四等份,分别加入同浓度的稀硝酸,充分反应后,在标准状况下生成NO的体积与剩余金属的质量见下表(设硝酸的还原产物只有NO)。
实验编号 | ① | ② | ③ | ④ |
稀硝酸体积(mL) | 100 | 200 | 300 | 400 |
剩余金属质量(g) | 9.0 | 4.8 | 0 | 0 |
NO体积(L) | 1.12 | 2.24 | 3.36 | V |
则硝酸的浓度为 ;③中溶解铜的质量为 ;④中V= 。
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题9金属及其化合物练习卷(解析版) 题型:选择题
某溶液仅含Fe2+、Na+、Al3+、Ba2+、S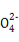 、N
、N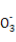 、Cl-中的4种离子,所含离子的物质的量均为1 mol。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。下列说法不正确的是( )
、Cl-中的4种离子,所含离子的物质的量均为1 mol。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。下列说法不正确的是( )
A.若向该溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体的质量为72 g
B.若向该溶液中加入过量的稀硫酸,产生的气体遇空气能变成红棕色
C.若向该溶液中加入过量的稀硫酸和KSCN溶液,溶液显血红色
D.该溶液中所含的离子是:Fe2+、Na+、SO42-、NO3-
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题8电化学原理练习卷(解析版) 题型:选择题
下列叙述中,不正确的是( )
A.原电池是将化学能转化为电能的装置
B.轮船底部镶嵌锌块,锌作负极,以防船体被腐蚀
C.钢铁腐蚀的负极反应:Fe-3e-=Fe3+
D.电镀时,镀层金属作阳极,镀件作阴极
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题6化学反应速率和化学平衡练习卷(解析版) 题型:选择题
近年来,由于温室效应和资源短缺等问题,关于CO2和碳酸盐应用的研究受到人们的重视。某研究小组利用反应:CO(g)+H2O(g) H2(g)+CO2(g) ΔH=-41.2 kJ/mol制备CO2与H2的混合气体,并进一步研究CO2与H2以不同的体积比混合时在合适条件下的反应产物应用。
H2(g)+CO2(g) ΔH=-41.2 kJ/mol制备CO2与H2的混合气体,并进一步研究CO2与H2以不同的体积比混合时在合适条件下的反应产物应用。
(1)已知:850 ℃时在一体积为10 L的恒容密闭容器中,通入一定量的CO和H2O,CO和H2O浓度变化如图所示:
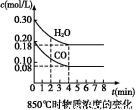
下列说法正确的是 (填序号)。
A.达到平衡时,氢气的物质的量是0.12 mol
B.达到平衡时,反应体系最终会放出49.44 kJ热量
C.第4 min时,混合气体的平均相对分子质量不再变化
D.第6 min时,若升高温度,反应平衡常数会减小
E.第8 min时,若充入氦气,会导致v(CO)正<v(H2O)逆
(2)850 ℃时,若在容积为2 L的密闭容器中同时充入1.0 mol CO、3.0 mol H2O、1.0 mol CO2和x mol H2。若要使上述反应开始时向正反应方向进行,则x应满足的条件是 。
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题3氧化还原反应 离子反应练习卷(解析版) 题型:选择题
在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系。下列关于离子共存说法中正确的是( )
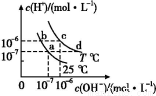
A.a点对应的溶液中大量存在:Fe3+、Na+、Cl-、S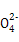
B.b点对应的溶液中大量存在:N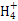 、Ba2+、OH-、I-
、Ba2+、OH-、I-
C.c点对应的溶液中大量存在:Na+、Ba2+、Cl-、HC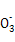
D.d点对应的溶液中大量存在:Na+、K+、S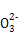 、Cl-
、Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com