
| n |
| V |
| 2.480g |
| 31g/mol×4 |
| 0.03mol×137.5 |
| 14.55 |
| 15.725g |
| 74g/mol |
| 0.125mol |
| 2.5L |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、二氧化硅既溶于强酸,又溶于强碱 |
| B、铁在纯氧中的燃烧产物是红棕色固体 |
| C、盐酸滴加到水玻璃中,可以产生白色胶状物质 |
| D、铜的金属活动性比铝弱,可用铜罐代替铝罐贮运浓硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
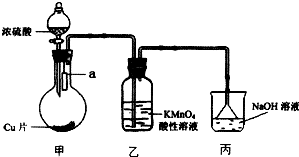 实验室可用如图装置(加热装置略)制取SO2以及验证SO2性质.
实验室可用如图装置(加热装置略)制取SO2以及验证SO2性质.查看答案和解析>>
科目:高中化学 来源: 题型:
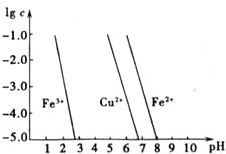 如图横坐标为溶液pH,纵坐标为金属离子物质的量浓度的对数值(当溶液中金属离子浓度≤10-5mol?L-1时,可认为沉淀完全),试回答:
如图横坐标为溶液pH,纵坐标为金属离子物质的量浓度的对数值(当溶液中金属离子浓度≤10-5mol?L-1时,可认为沉淀完全),试回答:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应体系的总压恒定 |
| B、B的浓度不变 |
| C、C(A):C(B)=1:3 |
| D、每生成3mol的B同时生成1mol的A |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com