
分析 (1)首先计算氧气的物质的量,根据方程式计算CaO2的物质的量;
(2)根据CaCO3沉淀的质量可得样品中Ca元素的质量,根据Ca元素质量守恒计算CaO的质量,总质量减去CaO2和CaO的质量即得水的质量,进而计算H2O和CaO2的物质的量比值,即可得到x的值.
解答 解:(1)n(O2)=$\frac{0.0672L}{22.4L/mol}$=0.003mol,
2(CaO2•xH2O)$\frac{\underline{\;\;△\;\;}}{\;}$2CaO+O2↑+2xH2O
2mol 1mol
n(CaO2•xH2O) 0.003mol
n(CaO2•xH2O)=0.006mol,
则n(CaO2)=n(CaO2•xH2O)=0.006mol,
故答案为:0.006mol;
(2)n(CaCO3)=$\frac{0.70g}{100g/mol}$=0.007mol,
①样品中水的质量为:m(H2O)=0.542g-m(CaO2)-m(CaO)=0.542g-0.006mol×72g/mol-0.056g=0.054g,n(H2O)=$\frac{0.054g}{18g/mol}$=0.003mol,
x=$\frac{n({H}_{2}O)}{n(Ca{O}_{2})}$=$\frac{0.003mol}{0.006mol}$=0.5,
n(H2O)=$\frac{0.054g}{18g/mol}$=0.003mol,
x=$\frac{n({H}_{2}O)}{n(Ca{O}_{2})}$=$\frac{0.003mol}{0.006mol}$=0.5,
答:样品中CaO2•xH2O的x值为0.5;
②根据Ca元素守恒,可知:n(CaO)=0.007mol-0.006mol=0.001mol,
所以样品的组成为:CaO•6CaO2•3H2O,
故答案为:CaO•6CaO2•3H2O.
点评 本题考查混合物的计算,题目难度中等,注意根据反应的化学方程式,从质量守恒的角度计算.


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:填空题
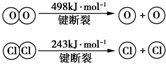 用Cl2生产某些含氯有机物时会产生副产物HCl.利用反应A,可实现氯的循环利用.反应A:4HCl+O2$\frac{\underline{\;CuO/CuCl_{2}\;}}{400℃}$Cl2+H2O,已知:反应A中,4mol HCl被氧化,放出115.6kJ的热量.
用Cl2生产某些含氯有机物时会产生副产物HCl.利用反应A,可实现氯的循环利用.反应A:4HCl+O2$\frac{\underline{\;CuO/CuCl_{2}\;}}{400℃}$Cl2+H2O,已知:反应A中,4mol HCl被氧化,放出115.6kJ的热量. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PH=1的溶液中:Na+、K+、MnO4-、CO32- | |
| B. | 由水电离出的C(H+)=1×10-13mol•L-1的溶液中:Mg2+、Cu2+、SO42-、NO3- | |
| C. | 无色溶液中:Cu2+、Al3+、NH4+、Cl- | |
| D. | 0.1 mol•L-1FeCl3溶液中:Fe2+、NH4+、AlO2-、S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验编号 | 温度/℃ | H2O2浓度/% | 其它试剂 | 实验目的 |
| ① | 20 | 5 | 无 | (Ⅰ)实验①和②探究催化剂对H2O2分解速率的影响; (Ⅱ)实验②和③探究温度对该反应速率的影响; (Ⅲ)实验②和④探究H2O2浓度对该反应速率的影响. |
| ② | 20 | 5 | FeCl3 溶液 | |
| ③ | ||||
| ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
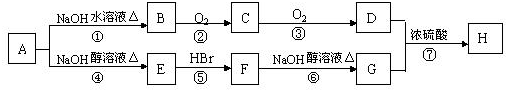
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+ | B. | SO42- | C. | S 2- | D. | NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2的电子式: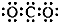 | |
| B. | 质量数为37的氯原子:${\;}_{37}^{17}$Cl | |
| C. | NH4Cl的电子式: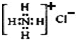 | |
| D. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用96%的工业酒精制取无水乙醇,可采用的方法是加生石灰,再蒸馏 | |
| B. | 在组装蒸馏装置时,温度计的水银球应伸入液面下 | |
| C. | 在苯甲酸重结晶实验中,粗苯甲酸加热溶解后还要加少量蒸馏水 | |
| D. | 在苯甲酸重结晶实验中,待粗苯甲酸完全溶解后要冷却到常温才过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
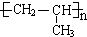 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com