
| A. | 二氧化硅与任何酸都不反应 | |
| B. | 二氧化碳通入水玻璃中能得到硅酸沉淀 | |
| C. | 硅的性质很稳定,能以单质形式存在于地壳中 | |
| D. | 二氧化硅溶于水显酸性 |
 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:解答题
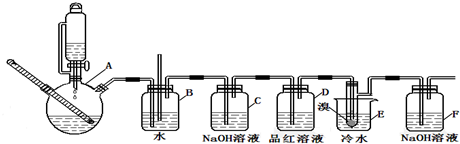
| 乙醇 | 1,2二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g/cm2 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ① | C. | ④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.5mol•L-1 | B. | 4.5mol•L-1 | C. | 7.0mol•L-1 | D. | 9.0mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.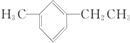 名称为1-甲基-3-乙基苯.
名称为1-甲基-3-乙基苯.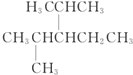 名称为:2,4-二甲基-3-乙基戊烷.
名称为:2,4-二甲基-3-乙基戊烷.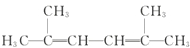 名称为:2,5-二甲基-2,4-己二烯.
名称为:2,5-二甲基-2,4-己二烯. ;
;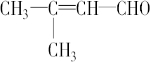 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+Na+Br-S2- | B. | Al3+Ca2+NO3-Cl- | ||
| C. | Na+K+AlO2- NO3- | D. | K+Na+SO42-S2O32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中导电粒子的数目增加,导电性增强 | |
| B. | 醋酸的电离程度增大,c(H+)减小 | |
| C. | 再加入10mL pH=11 NaOH溶液,混合液pH=7 | |
| D. | 溶液中由水电离出的c(H+)=1×10-3 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | pH=2的HA溶液与pH=12的MOH溶液以任意比混合:c(H+)+c(M+)═c(OH-)+c(A-) | |
| B. | NH4Cl溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| C. | 常温下,将醋酸钠、盐酸两溶液混合呈中性的溶液中:c(Na+)>c(Cl-)=c(CH3COOH) | |
| D. | 常温下,等物质的量浓度的三种溶液①(NH4)2CO3②(NH4)2SO4③(NH4)2Fe(SO4)2)中c(NH4+):①<③<② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 浓度 | c(NH3)(mol/L) | c(O2)(mol/L) | c(NO)(mol/L) |
| 起始 | 0.8 | 1.6 | 0 |
| 第2min | 0.6 | a | 0.2 |
| 第4min | 0.3 | 0.975 | 0.5 |
| 第6min | 0.3 | 0.975 | 0.5 |
| 第8min | 0.7 | 1.475 | 0.1 |
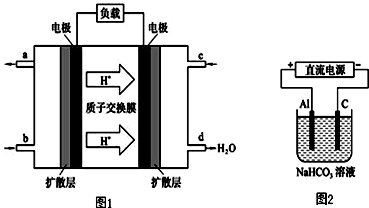
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com